
Занятие 23. Железо
(Занятие рассчитано на 2 часа.)
Работа 1. Отпуск и закалка стали.
Оборудование: спиртовка и спички, лучинка, лезвие от безопасной бритвы, стакан или банка с водой.
1. Укрепив в расщеплённой на конце лучинке лезвие от безопасной бритвы, накалите его докрасна в пламени спиртовки. Дайте лезвию медленно остыть и убедитесь в том, что теперь сталь отпущена и может быть легко согнута.
2. Снова тем же способом накалите лезвие докрасна и быстро опустите в холодную воду. Теперь сталь снова закалилась и при попытке согнуть ломается.
Работа 2. Свойства соединений трёхвалентного железа.
Оборудование: спиртовка и спички, стойка с 7 пробирками, синяя лакмусовая бумага, растворы: FeCl3, NaOH, НСl, H2SO4, HNO3, KCNS (или NH4CNS).
1. С помощью растворов хлорного железа и едкого натра (или едкого кали) приготовьте в пробирке осадок гидрата окиси железа. Отметьте его внешний вид. Напишите равенство проделанной реакции.
Распределите осадок в 4 пробирки.
2. Прилейте в первую пробирку раствор едкого натра (или едкого кали), во вторую - раствор соляной кислоты, в третью - раствор азотной кислоты и в четвёртую- раствор серной кислоты и убедитесь, что гидрат окиси железа не реагирует с раствором щёлочи, но реагирует с растворами соляной, азотной и серной кислот. Напишите уравнения трёх последних реакций.
3. Нагрейте 5-10см3 воды в пробирке до кипения и прибавьте к ней несколько капель раствора хлорного железа и хорошо перемешайте.
Образуется коллоидный раствор гидрата окиси железа.
4. К раствору хлорного железа добавьте раствор роданистого калия KCNS или роданистого аммония NH4CNS (соли роданистоводородной кислоты HGNS). Жидкость принимает кровавокрасный цвет, вследствие образования роданового железа Fe(CNS)3. Напишите уравнение реакции. Эта реакция является характерной для солей трёхвалентного железа.
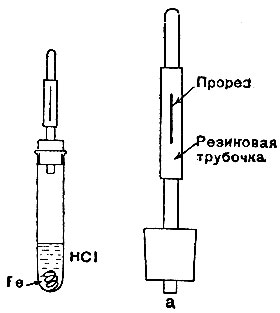
Рис. 25
Работа 3. Свойства соединений двух валентного железа.
Оборудование: спиртовка и спички, пробирка с пробкой и каучуковым клапаном*; 2 кусочка стальной струны, стойка с 4 пробирками, растворы: FeCl3, HG1 (1 : 1), NaOH, KCNS или NH4GNS, хлорная вода.
* (Каучуковый клапан представляет собой короткую стеклянную трубку, на которую надет обрезок резиновой трубки длиной около 5 см, закрытый с противоположного конца кусочком стеклянной палочки. В резиновой трубке острым ножом или бритвой сделан продольный разрез длиной около 2 см (см. рис. 25 а).)
1. Напишите уравнение реакции взаимодействия железа с соляной кислотой.
2. В пробирку с раствором соляной или сорной кислоты бросьте кусочек стальной струны и тотчас же закройте пробкой с каучуковым клапаном. Последний не даёт воздуху проникнуть в пробирку, но позволяет выйти из неё образующемуся газу (рис. 25). Для ускорения реакции содержимое пробирки можно слегка подогревать (не до кипения). Когда растворение железа закончится, обратите внимание на небольшой тёмный остаток, не взаимодействующий с кислотой. Почему струна не растворилась целиком ?
3. Разлейте полученную жидкость в 3 пробирки.
4. В первую пробирку прибавьте раствора роданистого калия (KCNS) или роданистого аммония (NH4CNS). Кровавокрасного окрашивания не получается.
5. Во вторую пробирку прибавьте раствора едкого натра (или едкого кали). В первый момент образуется белый осадок, который, однако, быстро зеленеет, а при длительном соприкосновении с воздухом буреет. Дайте объяснение этим явлениям.
6. В третью пробирку добавьте хлорной воды. Ответьте и объясните наблюдаемое при этом изменение окраски. Прилейте сюда же раствора роданистого калия. Почему теперь появляется характерное кровавокрасное окрашивание?
7. К раствору хлорного железа прибавьте соляной кислоты и несколько маленьких кусочков железной струны или немного опилок. Хлорное железо восстанавливается в хлористое. Убедитесь в этом по изменении окраски раствора.
Задачи.
1. Докажите, что выданные вам кристаллы железного купороса частично окислились и содержат примесь соединения трёхвалентного железа. Опишите, как вы это сделали.
2. В процессе производства щелочей нередко применяют железную аппаратуру. Благодаря этому едкий натр и едкое кали часто содержат железо. Испытайте применяемый вами раствор щёлочи на содержание в нём соединений трёхвалентного железа. Опишите, как вы это сделали.
3. Получите сернокислое железо из FeCl,, и других необходимых для этого веществ. Опишите проделанную работу, приведя соответствующие уравнения реакций.
4. К раствору хлорного железа прибавьте соляной кислоты. Объясните наблюдаемое посветление раствора. 52
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'