
Занятие 27. Определение молекулярного веса углекислого газа
(Занятие рассчитано на 2 часа. )
Оборудование: колба с пробкой, спички, барометр, термометр, мензурка, аппарат Киппа, химико-технические весы с разновесом, таблица логарифмов (или логарифмическая линейка).
Для нахождения молекулярного веса газа по формуле ' М- = 22,4D необходимо определить вес 1 литра газа при нормальных условиях.
Порядок работы.
1. Взвесьте колбу, закрытую пробкой* 2. Найденный вес колбы с воздухом запишите.
* (Взвешивание достаточно производить с точностью до 0,01 г. )
2. Наполните колбу газом из аппарата Киппа, вставив конец стеклянной трубки до дна колбы; испытайте зажжённой спичкой, наполнилась ли колба газом (спичка должна потухнуть). Зажжённую спичку держите над отверстием колбы. После наполнения колбы газом закройте её той же пробкой.
3. Взвесьте колбу с газом. Вес колбы с газом запишите.
4. Пропустите второй раз в колбу газ из аппарата Киппа. Убедитесь в наполнении колбы газом и вторично взвесьте. Если вес не увеличился, наполнять третий раз не следует. Если же будет разница в весе, пропустите в колбу газ в третий раз и снова взвесьте. Запишите окончательный вес колбы с газом.
На основании полученных данных вычислите вес газа в колбе, а потом и вес 1л газа при нормальных условиях.
Порядок вычисления.
(Все вычисления делайте с помощью таблицы логарифмов.)
1. Определите вес пустой колбы, для чего:
а) найдите объём воздуха в колбе при нормальных условиях (объём воздуха при данных условиях равен объёму колбы, который можно измерить водой при помощи мензурки); давление воздуха в комнате отсчитайте по барометру, а температуру - по термометру;
б) вычислите вес воздуха (1 см3 воздуха при нормальных условиях весит 0,0012935 г);
в) вычислите вес пустой колбы (без воздуха).
2. Определите вес исследуемого газа в колбе.
3. Определите вес 1 л газа при нормальных условиях.
(Объём газа при нормальных условиях будет такой же,
как и объём воздуха при нормальных условиях.)
4. Вычислите вес граммолекулы газа при нормальных условиях по формуле:
М = 22,4 D.
(Молекулярный вес газа численно равен его граммолекулярному весу.)
Проделанную работу и все вычисления запишите в тетради по прилагаемой форме.
Отчёт о работе по определению молекулярного веса углекислого газа (число, месяц, год).
1. Температура, и давление воздуха в лаборатории
t = ....., p = ....
2. Объём колбы V =
3. Вес колбы с воздухом и пробкой в граммах %=*
4. Вес колбы с газом: I взвешивание . . .
≥≥≥≥ II взвешивание . . . . . .
≥≥≥≥ III взвешивание . . . . . . .
5. Объём воздуха в колбе при нормальных условиях:
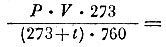
6. Вес воздуха в колбе =
7. Вес пустой колбы =
8. Вес исследуемого газа =
9. Вес 1 л углекислого газа при нормальных условиях =
10. Вес г-мол газа =
11. Молекулярный вес М =
12. Ошибка в определении (в %) =
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'