
Занятие 28. Углеводороды
(Опыты по метану и этилену проводятся после изучения этилена. Они рассчитаны на 2 часа. Остальные опыты проводятся в за ключение темы "Углеводороды" (они рассчитаны на одночасовое занятие). Вся работа может быть проведена и в одно двухчасовое занятие. В этом случае часть учащихся проделывает опыт по метану
и ацетилену, а другая часть - по этилену и бензолу.)
Оборудование: железный и штатив, сетка, спиртовка, ванночка (или широкий стакан) с водой, воронка, 2 пробирки с пробкой и отводной трубкой, колба Вюрца на 50 см3 (или колба с пробкой и отводной трубкой), стеклянные трубочки: прямая, прямая с оттянутым концом, изогнутая оттянутым концом, небольшой стеклянный цилиндр с. пробкой, стеклянная банка или стакан, стойка с 5 - 6 пробирками, спички, лучинка, фильтровальная бумага уксуснокислый натрий (плавленный), натронная известь, бромная вода, раствор КМnO4, баритовая вода, смесь этилового спирта концентрированной серной кислотой (в отношении 1 : 3), песок, раствор соды, карбид кальция (кусочек величиной с горошину),-эфир, спирт, вода, жир (растительное масло или сало).
1. Метан.
Опыт 1Получение метана..
Метан вы будете подучать путём взаимодействия безводного уксуснокислого натрия с натронной известью (NaOH и СаО), При; нагревании смеси идет реакция:
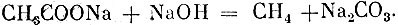
1. Приготовьте на листке бумаги смесь мелко истолчённого уксуснокислого натрия и натронной извести, взяв на 1 часть соли примерно 2 части натронной извести (по объёму).
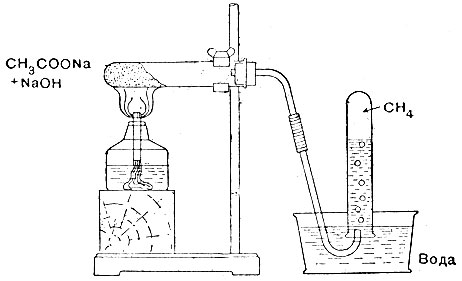
Рис. 26
2. Всыпьте смесь в пробирку. Смесь должна занимать около объёма пробирки. Пробирку закройте пробкой с отводкой трубкой и укрепите в штативе (рис. 26).
3. Прогрейте пробирку и начните нагревать смесь около дна. После того как вещества здесь прореагируют, передвигайте спиртовку дальше так, чтобы смогли реагировать новые порций смесей.
4. Заполните выделяющимся газом пробирку по способу вытеснения воды.
5. Закройте пробирку под водой пальцем, поднесите к пламени лучинки и откройте. Происходит лёгкий взрыв смеси метана с воздухом.
6. Заносите газом также вторую пробирку и проверьте, как горит этот газ. Метан горит еле светящим пламенем*.
* (Светимость пламени обусловлена примесями.)
7. Заполните чистым метаном 2 пробирки. Закройте их плотно резиновыми пробками и поставьте в штатив. Они будут нужны для опыта 3.
8. Не прекращая нагревания смеси, отставьте ванночку и приступите к следующему опыту.
Опыт 2. Определение качественного состава метана.
Качественный состав метана можно определить по продуктам его горения.
1. Подожгите лучинкой метан непосредственно у газоотводной трубки после того, как горение метана в пробирке покажет, что воздух вытеснен из прибора.
2. Над пламенем метана поместите сухую воронку или опрокинутый стакан (рис. 27). Заметьте образование влаги на стенках воронки или стакана.
3. Сполосните воронку или стакан Рис. 27. баритовой водой и опрокиньте над пламенем метана. Наблюдайте помутнение баритовой воды вследствие образования углекислого газа при горении.
О наличии каких элементов в метане свидетельствует результат опыта?
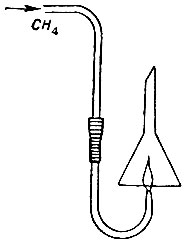
Рис. 27
Опыт 3. Метан легче или тяжелее воздуха?
1. Возьмите пробирки, содержащие метан, таким образом, чтобы одна была в нормальном положении, а Другая перевёрнута вверх дном.
2. Откройте пробирки и держите их в таком положении около 15-20 секунд.
3. Постарайтесь поджечь метан сначала в одной пробирке, затем в другой. Почему горение наблюдается только в одном случае?
2. Этилен.
Опыт 1. Получение и горение этилена.
Этилен вы будете получать нагреванием этилового спирта с концентрированной серной кислотой. 60
1. Соберите прибор, как показано на рис. 28. В колбу Вюрда (ёмкостью 50 см3) налейте 10-15 см3 заготовленной заранее смеси спирта с серной кислотой. К смеси добавьте немного чистого песка или пемзы, чтобы избежать толчков при кипении. Нагревайте смесь.
(Вместо колбы можно воспользоваться широкой пробиркой с отводной трубкой, взяв в неё несколько меньшее количество смеси).
Внимание! Если колба лопнет и спирт загорится, быстро потушите спиртовку и засыпьте пламя большим количеством песка. Если брызги попадут на кожу или одежду, быстро промойте водой, затем большим количеством раствора соды и снова водой.
2. Когда можно будет предполагать, что воздух вытеснен из колбы (или пробирки), подожгите газ у отводной трубки прибора. Наблюдайте светимость пламени этилена.
Опыт 2. Отношение этилена к бромной воде и к окислителям.
1. Замените в приборе (рис. 26) изогнутую отводную трубку небольшой прямой трубочкой.
2. Пропускайте этилен (всё время продолжая нагревание смеси) в пробирку с бромной водой. Вода вскоре обесцвечивается. Напишите уравнение реакции.
3. Пропускайте этилен в пробирку с подкислённым раствором КМnO4. Фиолетовая окраска марганцевокислого калия исчезает вследствие окисления им этилена.
4. Удалите трубочку из жидкости и потушите спиртовку. Дайте прибору остыть.
5. Слейте содержимое колбы в указанный преподавателем сосуд и осторожно вымойте колбу водой.
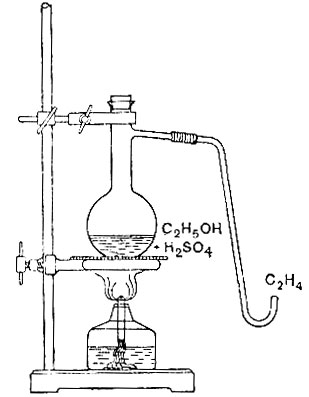
Рис. 28
3. Ацетилен.
Опыты с ацетиленом следует производить в вытяжном шкафу или в хорошо проветриваемой лаборатории.
Опыт 1. Получение и горение ацетилена.
1. Налейте в пробирку (на 1/5) воды и бросьте в неё 2-3 маленьких кусочка карбида кальция.
2. Быстро поместите в верхнюю часть пробирки неплотный ватный тампон (чтобы не выбрасывало жидкость газом) и закройте пробирку пробкой с короткой вертикальной трубочкой, верхний конец которой оттянут. Подожгите выделяющийся газ. Обратите внимание, что он горит коптящим пламенем.
3. Вдувайте воздух в пламя ацетилена с помощью паяльной трубки или стеклянной трубочки с оттянутым концом. Пламя становится ярко светящим.
Опыт 2. Отношение ацетилена к окислителям.
1. Потушив пламя ацетилена, быстро закройте пробирку пробкой с изогнутой отводной трубкой.
2. Конец отводной трубки опустите в подкислённый раствор КМnO4, как показано на рис. 29.
Объясните обесцвечивание раствора.
3. Закончив работу, оставьте пробирку в вытяжном шкафу или сдайте преподавателю.
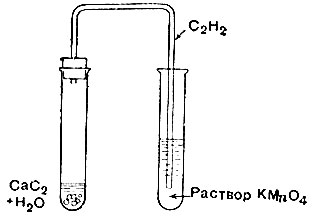
Рис. 29
4. Бензол.
Опыт 1. Растворимость бензола в различных жидкостях.
1. Налейте в одну пробирку (на 1/5) воды, в другую - столько же спирта, в третью - столько же эфира.
2. В каждую из этих пробирок прилейте по равному объёму (около 0,5 см3) бензола. Встряхните пробирки и поставьте рядом в штатив. Отметьте, в какой жидкости бензол нерастворим.
Опыт 2. Бензол как растворитель.
1. Налейте в одну пробирку около 1-2 см3 бензола, в другую пробирку - столько же воды.
2. В обе пробирки добавьте по маленькому кусочку сала или по нескольку капель масла. Взболтайте содержимое пробирок; поставьте их рядом в стойку для пробирок. Наблюдайте растворение жира в бензоле.
3. На лист фильтровальной бумаги нанесите каплю чистого бензола и рядом - каплю раствора жира в бензоле. Наблюдайте испарение бензола. От капли раствора остаётся пятно жира.
Опыт 3. Горение бензола.
Смочите бензолом узкую полоску фильтровальной бумаги и подожгите её. Наблюдайте коптящее пламя бензола. Параллельно проследите, как горит бумажка, не смоченная бензолом.
Опыт 4. Отношение бензола к бромной воде и раствору КМnO4.
В две пробирки налейте по 0,5 см3 бензола. В одну пробирку добавьте бромной воды, в другую раствор КМnO4. Встряхивайте содержимое пробирок. Обесцвечивания растворов не происходит.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'