
Рост алмазного порошка при низких давлениях
Сущность процесса. Рост алмаза в области давлений и температур, при которых он становится менее стабильной формой углерода, а стабильной - является графит, возможен. В этом случае говорят о получении алмаза при низких давлениях. Низкие давления - давления как в сотни атмосфер, так и в долю атмосферы. Задача заключается в том, чтобы подбором соответствующих условий эксперимента сделать появление зародыша и рост алмаза более вероятным.
Вероятность роста алмаза значительно увеличивается, если уже есть затравка алмазного кристалла. В соответствующей углеводородной среде, например в метане, на поверхности алмазной затравки происходят реакции разложения:
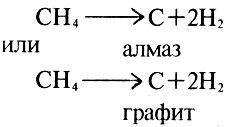
При равновесной концентрации числа атомов углерода, присоединяющихся к кристаллу и покидающих его поверхность, равны, так что кристалл одновременно растет и травится и суммарная скорость его роста равна нулю. Если концентрация атомов углерода выше равновесной, избыток этих атомов (по сравнению с равновесной концентрацией) будет выделяться на грани кристалла. При этом под влиянием автоэпитаксии они будут стремиться продолжить "кирпичную кладку" подложки. Однако если концентрация атомов углерода около кристалла слишком велика и процесс их выделения на грани затравки идет слишком быстро, то становится возможным образование и рост графита как термодинамически более устойчивой формы углерода, что перевесит влияние автоэпитаксии. Вначале образование графита и рост алмаза будут идти одновременно на разных участках поверхности, но затем графит покроет всю поверхность кристалла и рост алмаза прекратится.

Рост алмаза в газовой фазе при низких давлениях. Метан разлагается - на поверхности кристалла нарастает алмаз (внизу) и графит (вверху)
Термодинамические расчеты показывают, что равновесная концентрация углерода в химических соединениях, в паре и в растворе над алмазом при низких давлениях выше, чем над графитом. Поэтому всегда есть вероятность появления графита, блокирующего поверхность алмаза и исключающего его дальнейший рост. Основная трудность роста алмаза при низких давлениях состоит именно в предотвращении выделения или в устранении стабильной фазы углерода - графита. Это делается разными способами. Можно периодически прерывать синтез и удалять тем или иным методом графит с поверхности алмазных кристаллов. Можно подобрать такие условия синтеза, когда скорость роста алмаза настолько больше скорости роста графита, что включения последнего будут "замуровываться" в слоях алмаза. Наконец, можно попытаться создать такой режим синтеза, чтобы графит не образовывался вовсе.
Увеличить в размере кристаллы алмаза в соответствующей углеродсодержащей среде весьма заманчиво. Первая попытка подобного эксперимента относится к началу нашего века, а сейчас все чаще в разных странах появляются патенты и журнальные статьи по этому вопросу.
В 1956 г. ученым Института физической химии АН СССР Б. В. Дерягину и Б. В. Спицыну удалось получить первый патент по наращиванию алмазных затравочных кристаллов из газа. В своих экспериментах они использовали четырехбромистый углерод. Спустя некоторое время, в 1958 г., два патента, относящиеся к наращиванию алмазных порошков, получил американец В. Эверсол. В первом из них рассматривается рост алмаза из углеводородов, содержащих метильные группы, во втором - его рост при разложении окиси углерода. Поскольку одновременно с алмазом растет и графит, Эверсол периодически прерывал процесс и удалял графит травлением в среде водорода при 100 ат и 1000°С.
Аппаратура и методика наращивания алмазных порошков. Группа исследователей, возглавляемая Б. В. Дерягиным и Д. В. Федосеевым, экспериментально и теоретически изучала синтез алмаза из газов, стремясь проникнуть в механизм роста алмаза и графита. С самого начала в их работе тесно переплетались две цели: научная и практическая.
Прежде всего экспериментаторы выясняли зависимость скорости роста алмаза (и графи га попутно) от таких параметров, как температура и давление углеродсодержащих газов. Опыты проводились на лабораторных установках, состоящих из реактора синтеза и вакуумной системы. Реактор, обычно цилиндрической формы, делается из кварца и способен выдерживать температуру до 1200°С. Он находится внутри печи, которая изготовлена из проволоки или ленты специального сплава. При пропускании электрического тока лента нагревается и нагревается в свою очередь реактор. Температура реактора измеряется несколькими термопарами, помещенными в специальный кварцевый карман.
Вакуумная система включает вакуумные насосы, блок очистки и хранения газов, ряд манометров разного типа для измерения давления газов в широком диапазоне давлений и расходомер газа.
Алмазный порошок предварительно взвешивается и помещается в реактор в маленькой кварцевой чашечке. В первых установках по исследованию кинетики роста алмаза количество порошка составляет около 0,1 карата, т. е. 20 мг. Чашечка с алмазным порошком на длинной тонкой кварцевой нити подвешивалась к градуированной пружине, сделанной из кварцевой спирали. Сама спираль находилась в холодной зоне реактора, а чашечка с алмазным порошком - в горячей. За специальной отметкой на кончике спирали можно было наблюдать через небольшой микроскоп с делениями: так с точностью миллионной доли грамма измерялось изменение веса образца алмаза.
Во всех измерениях, связанных с исследованием кинетики роста алмаза, использовались высокодисперсные (тонкоизмельченные) алмазные порошки, которые обладают большой удельной поверхностью - суммарной поверхностью всех частиц, содержащихся в 1 г порошка. Чем меньше размер частиц, тем больше удельная поверхность. Вы сами можете легко в этом убедиться, последовательно дробя, например, первоначальный кубик с ребром 1 см на кубики с меньшим ребром.
Допустим, что в процессе наращивания получен слой алмаза толщиной 10 ангстрем. Если взять один кристаллик алмаза весом 20 мг, то он будет представлять кубик с ребром около 4 мм и общей площадью около 1 см2. Чему будет равен полученный привес алмаза в этом случае? Зная плотность алмаза, легко найти, что привес будет равен 0,35*10-3 мг. Такой привес лежит за пределами чувствительности выбранных нами весов.
Теперь возьмем те же 20 мг, но в виде порошка с такими мелкими частицами, что его удельная поверхность будет равна 10 м2 на 1 г алмаза. Тогда общая поверхность порошка, на которой может происходить рост алмаза, составит 0,2 м2, а привес - 0,7 мг, что намного больше чувствительности весов. Таким образом, можно при данном привесе алмаза измерять скорость его роста.

Реактор для наращивания алмазных порошков. Он состоит из реактора и вакуумной системы. Реактор способен выдерживать температуру до 1200° С
Удельная поверхность. Это одна из важнейших характеристик порошкообразных материалов, и недаром для многих из них она вводится в Государственный стандарт. Важность этой характеристики заключается в существенной зависимости от нее эффективности многих технологических процессов.
В топках тепловых электростанций сжигается мелкодробленый уголь и распыленный мазут. При этом в зависимости от размеров частиц угля или капель мазута, т. е. их удельной поверхности, достигается заданная скорость выделения энергии при горении.
Медицинские препараты также сушат в виде порошков с заданной удельной поверхностью. Многие лекарства изготавливаются таким образом, чтобы после их приема они распадались на порошок с нужной удельной поверхностью. Тем самым можно регулировать скорость поступления медикамента внутрь организма.
При внесении удобрений особенно с помощью авиации используются также порошки с необходимой удельной поверхностью.
Наконец, посмотрите, как ведет себя быстрорастворимый сахар, если его положить в чай. Он распадается на отдельные мелкие кристаллики, которые растворяются самостоятельно. Именно это и делает его быстрорастворимым.

Определение удельной поверхности. В порошке (под микроскопом) проводят воображаемую прямую линию и образуют вокруг нее цилиндр с малой площадью сечения. Цилиндр как бы вырезает в порошке столбик с некоторым суммарным объемом частичек порошка. При помощи специальных формул рассчитывают этот объем
Разумеется, создано много методов определения удельной поверхности порошковых материалов. Но при всем кажущемся многообразии этих методов их можно разделить на три основные группы. Первая включает в себя способы определения удельной поверхности путем непосредственного измерения под микроскопом размеров частиц. Затем рассчитывается удельная поверхность. До недавнего времени эта операция проводилась практически вручную. Лаборант прямо в микроскопе или на фотографии проводил измерения. Сейчас созданы приборы, в которых это делается автоматически. В основу положен принцип бегающего электронного луча, подобного используемому в телевизоре. Электронный пучок бежит по поверхности пластины, на которую нанесены порошинки, а цифровая машина считает его отражение от частиц.
Вторая группа методов измерения удельной поверхности связана с поглощением газов поверхностью материалов. Это так называемые адсорбционные методы. Явление адсорбции заключается в прилипании молекул газа к поверхности. На этом основан принцип защитного действия противогаза, в котором имеется слой активированного угля. Такой уголь имеет очень большую удельную поверхность. Частицы активированного угля относительно крупные - до нескольких миллиметров. Но благодаря специальной обработке они имеют очень большую внутреннюю пористость в виде сообщающихся каналов.
Таким образом, при малой внешней удельной поверхности, определяемой геометрическими размерами частиц, они имеют очень большую внутреннюю удельную поверхность, обусловленную развитой внутренней пористостью. Например, рядовые активированные угли имеют удельную поверхность 500 кв. м на 1 г. 20 г такого угля имеют общую поверхность, равную одному гектару.
Молекула газа, прилипнув к поверхности, занимает определенную площадку. Если в замкнутом объеме измерить давление газа, а затем ввести в этот объем порошок, то произойдет изменение давления, поскольку часть газовых молекул сядет на поверхность этого порошка. Зная изменение давления в системе, количество введенного порошка и площадку, занимаемую одной молекулой на поверхности, можно легко определить общую поверхность порошка.
Внутренние и транспортные поры в порошке (под микроскопом)
Адсорбционные методы дают значение полной удельной поверхности - внутренней и внешней. Но во многих случаях необходима именно внешняя удельная поверхность, которая определяется крупностью зерен порошка. Для измерения только внешней удельной поверхности при наличии внутренней пористости частиц адсорбционные методы непригодны. В очень большом числе практически важных задач свойства материалов определяются крупностью. Примером этому могут служить абразивные порошки, в том числе и алмазные, используемые при обработке материалов. Порошки цемента, металлов для порошковой металлургии, красители нуждаются в характеристике лишь внешней удельной поверхности.
Большинство методов, определяющих внешнюю удельную поверхность порошков, основано на измерении сопротивления, которое столбик порошка оказывает течению через него газа или жидкости. Использование течения жидкости, например воды, менее целесообразно, так как может осложняться растворением частиц и другими причинами, связанными с их взаимодействием с жидкостью. Сопротивление столбика порошка протеканию через его поры газа в общем случае сложным образом зависит от отношения средней длины цробега газовых молекул от одного столкновения с другой молекулой до следующего к среднему просвету -пор. Закон течения газа упрощается в том предельном случае, когда это отношение становится много больше единицы. Закон течения газа через поры упрощается, потому что в этом случае молекулы газа сталкиваются между собой гораздо реже, чем со стенками пор.

Путь молекулы при диффузии порошка (под микроскопом)
Таким образом, различные молекулы газа движутся в основном независимо друг от друга, а изломы их траекторий определяются только столкновениями со стенками пор. Путь молекул имеет форму ломаной, зигзагообразной линии. В этом отношении имеется сходство с характером беспорядочного блуждания молекул растворенного вещества, сталкивающихся с окружающими молекулами растворителя. Само беспорядочное движение есть проявление теплового движения, средняя энергия которого, как известно из физики, растет пропорционально корню квадратному из абсолютной температуры. Такое беспорядочное движение растворенных молекул при наличии неравномерной концентрации приводит к переносу вещества из области с большой его концентрацией в область с меньшей концентрацией. Благодаря беспорядочному движению молекул запах духов, пролитых в одном конце комнаты, становится заметным через некоторое время во всем помещении. В данном случае воздух является растворителем, а переносятся молекулы (достаточно большие и сложные) душистой эссенции. Если рассмотреть диффузию молекул газа между частицами порошка, когда давление настолько мало, что молекулы практически не сталкиваются между собой, только с поверхностью частиц, то можно определить сопротивление диффузии. Чем крупнее порошок, тем больше зазоры между частицами, тем легче идет перенос вещества. Эта задача с сопротивлением слоя порошка была строго решена Б. В. Дерягиным, нашедшим зависимость между сопротивлением слоя порошка и размером частиц порошка. На этой основе разработан ряд приборов, успешно используемых в промышленности. В приборах простыми методами измеряется скорость переноса просачивания газа через слой порошка, и затем рассчитывается удельная поверхность.
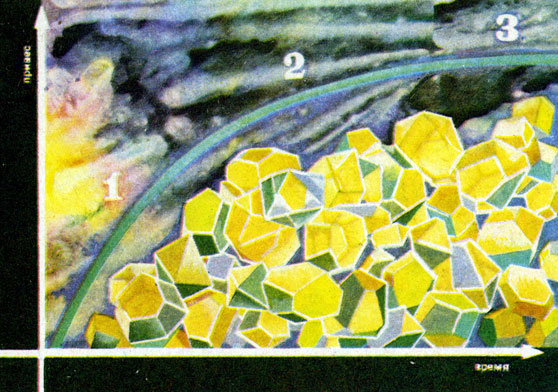
Кривая наращивания алмазных порошков
В случае наращивания алмаза из углеродсодержащей среды, к чему мы опять возвращаемся, предварительно определяют внешнюю удельную поверхность исходных алмазных порошков.
Итак, чашечка с алмазным порошком находится в реакторе. Из всей системы откачивается воздух (система вакуумируется). Реактор начинает нагреваться, и одновременно через него протекает при заданном давлении газ, например метан. Через определенные промежутки времени измеряется растяжение пружины, показывающее изменение веса алмазной затравки.
В результате экспериментов выявилась важная особенность: скорость роста алмаза из углеводородов в несколько раз больше скорости роста графита в тех же условиях. По скорости выделения углерода из газовой фазы весь процесс наращивания можно условно разбить на три стадии. Сначала растет практически один алмаз и скорость выделения углерода наибольшая. Затем она уменьшается, поскольку наряду с ростом алмаза начинает образовываться и расти графит. Наконец, скорость уменьшается до значения, характерного для скорости роста графита.
Результаты опыта можно представить в виде графика в координатах привес - время. Получится кривая, исходящая из начала координат и обращенная выпуклостью вверх. Если бы скорость роста графита была равна скорости роста алмаза, то на таком графике экспериментальные точки образовали бы прямую. Если бы скорость роста графита превышала скорость роста алмаза, то экспериментальная кривая имела бы выпуклость вниз.
Многочисленные опыты помогли установить зависимость скорости роста алмаза от температуры и давления сначала для метана, а затем и для других углеводородов: этана, пропана, этилена, ацетилена. Эксперименты проводились в специальной установке, где печка, изготовленная из графита, позволяла получать температуру до 2000°С. Они показали, что алмаз может расти и при температурах до 1700- 1800°С.
Так как вместе с ростом алмаза на затравочных кристаллах в газовой среде выделяется и графит, то появилась проблема очистки получаемого порошка от графита. Незачем, конечно, наращивать на алмазе толстые слои графита, чтобы затем его удалять. От графита целесообразно избавляться, когда он еще не полностью покрыл поверхность затравочных кристаллов алмаза. Исследования, проведенные в Институте физической химии, показали, что скорости газификации алмаза и графита кислородом воздуха (скорости окисления) различны, причем скорость окисления графита много выше. Это позволило разработать метод очистки затравочных кристаллов алмаза от графита путем окисления в воздушном потоке. Отпала необходимость переносить наращенный порошок для очистки из реактора в автоклав с водородом, а после очистки - обратно. Весь процесс наращивания - очистки теперь происходил только в реакторе. Метод получил название циклического. Вскоре он был уже запатентован в других странах.
С помощью циклического метода удалось нарастить исходное количество порошка в 4,4 карата (880 мг) на 61% за 30 циклов наращивания - очистки (по 1,5 ч каждый). Для сравнения укажем, что близкий относительный привес на аналогичном порошке Эверсол получил за 85 циклов наращивания- очистки (продолжительность каждого свыше 6 ч).
Кинетическая область роста алмаза. Тщательные исследования позволили ученым Института физической химий Академии наук СССР разработать математическую теорию процесса совместного роста алмаза и графита. Теория отлично объясняет экспериментальные результаты и подтверждается ими. Она находит подтверждение и в работах американских специалистов в области синтеза алмаза из газовой фазы.
Однако эта теория была построена для исследований, проведенных при условии практически одинаковой концентрации исходного метана во всем слое наращиваемого порошка, а при наращивании больших количеств алмазных порошков это условие может нарушаться. Оно нарушается, потому что приходится увеличивать толщину слоя алмазного порошка по конструктивным соображениям.
Скорость разложения метана пропорциональна поверхности, поэтому метан, проникая внутрь слоя алмазного порошка, расходуется тем быстрее, чем больше удельная поверхность порошка. Если толщина слоя порошка все же мала настолько, что, несмотря на разложение метана, его концентрация по всей толщине практически одинакова, то скорость роста алмаза определяется скоростью разложения метана - кинетическим фактором. Значит, процесс протекает в кинетической области.
Диффузионная область роста алмаза. Если толщина слоя порошка больше предельной, зависящей от дисперсности порошка, температуры реакции и некоторых других величин, то на некоторой глубине весь метан уже израсходуется и более глубокие слои алмаза наращиваться не будут. В этом случае в глубоких слоях концентрация метана существенно отличается от концентрации на поверхности, а поскольку в неподвижном газе (когда отсутствует вынужденное перемешивание) перенос вещества осуществляется благодаря диффузии, то процесс роста алмаза протекает в диффузионной области. Эта область хорошо исследована учеными.
Различие в росте алмаза и графита. Когда начинались исследования роста алмаза из газовой фазы, предполагалось, что механизмы роста алмаза и графита если не тождественны, то достаточно близки. Однако эти ожидания не оправдались. Оказалось, что графит и алмаз растут совершенно по-разному. Прежде всего это заметно на влиянии водорода. При разложении метана (и других углеводородов) водород является продуктом реакции. Добавление водорода в исходный метан существенно уменьшало скорость роста графита, но не замедляло скорости роста алмаза. Создавалось впечатление, что скорость роста алмаза при добавлении водорода даже увеличивается. Каким образом проводились эти исследования?
В чашечку с алмазным порошком вводились два графитовых контакта, и измерялось электрическое сопротивление между ними. Поскольку алмаз является диэлектриком, а графит - проводником, то по мере выделения графита на алмазных порошках сопротивление промежутка между электродами падает. Расстояние между электродами было фиксированным, алмазный порошок брался одной и той же зернистости. Значит, величина проводимости зависела только от количества высадившегося графита. Порошок после опыта взвешивался. Затем, удалив графит, можно было определить количество наращенного алмаза.
В определенных условиях при разбавлении метана водородом количество выделившегося графита уменьшалось, а алмаза увеличивалось. Увеличивался даже общий привес на затравочном алмазном порошке - алмаза и графита вместе. Казалось, что нарушается принцип Ле Шателье, по которому добавление продукта реакции тормозит ее. Однако принцип остался нерушим. В действительности при добавлении водорода уменьшаются скорости роста как алмаза, так и графита. Блокировка поверхности затравочных частиц графитом уменьшается. Но так как скорость роста алмазов из углеводородов значительно превышает скорость роста графита, а доля поверхности, на которой алмаз может расти, увеличивается, то увеличивается и суммарная скорость его роста.
Особенно разительно проявились различия в механизмах роста алмаза и графита при исследовании фракционирования (разделения) стабильных изотопов углерода.
Углерод имеет два стабильных изотопа: с атомным весом 12-С12 и атомным весом 13-С13. Геохимические исследования показали, что в природе все углеродсодержащие минералы (а к ним относятся графит и алмаз) имеют определенное соотношение между этими двумя изотопами. Природные алмазы изотопно "тяжелее" природного графита, т. е. в них содержится относительно больше тяжелого изотопа углерода С13. Более того, в кимберлитовых трубках алмазы изотопно тяжелее карбонатов окружающих пород.
Алмаз, синтезируемый методами высоких давлений, наследует изотопный состав графита, примененного для синтеза. При росте из метана образующийся алмаз становится изотопно "тяжелее", чем растущий графит. Алмаз выбирает из метана (в котором также имеется определенное соотношение С12 и С13) больше тяжелого изотопа углерода, а графит пользуется преимущественно легким изотопом.
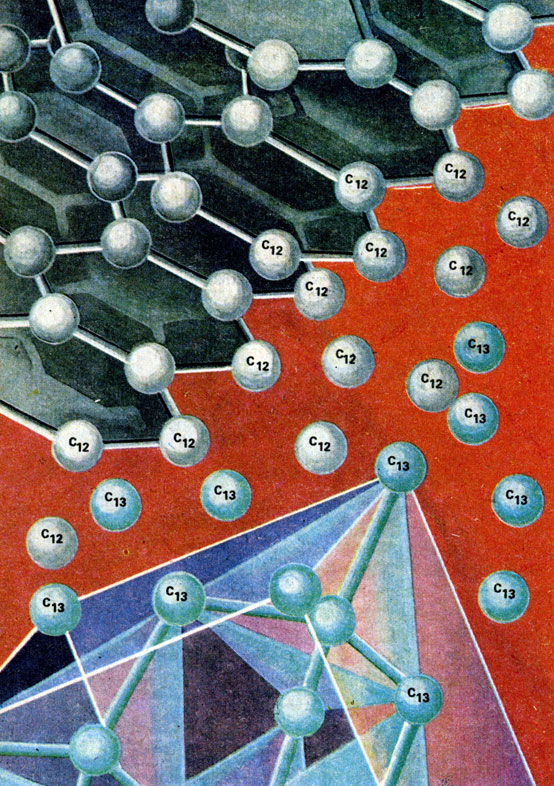
Различие в росте алмаза и графита из газовой фазы. При одновременной кристаллизации в алмазе оказывается относительно больше изотопа углерода С13, а в графите-С12
Совершенно естественно связать эти эффекты индивидуального подхода алмаза и графита к выбору изотопов с различными механизмами роста этих форм углерода.
Интересные явления наблюдаются при исследовании роста алмаза из смесей различных углеводородов. Скорость роста графита из смеси 0,1 мм рт. ст. метана и 0,1 мм рт. ст. этана равна сумме скоростей роста графита из отдельных газов при том же давлении. Скорость же роста алмаза из этой смеси будет меньше, нежели сумма скоростей роста из отдельных компонентов при тех же парциальных давлениях.
Это тоже объясняется различными механизмами роста графита и алмаза.
Можно предположить, что графит растет плоскими слоями, параллельными поверхности затравки, из молекул углеводорода, находящихся на поверхности и попадающих в область роста из газовой фазы. Чем больше степень покрытия поверхности молекулами углеводородов, тем интенсивнее рост графита. Графит может образоваться только из большого числа молекул метана (или другого углеводорода), сидящих непосредственно на поверхности. Но чем большая часть поверхности занята водородом, тем меньше там будет находиться молекул углеводорода. Алмаз же растет только на той части поверхности затравочного кристалла, которая свободна от молекул углеводородов. Но он может образовываться и на поверхности, покрытой атомами водорода. Поэтому разбавление, например, метана водородом увеличивает скорость роста алмаза и уменьшает скорость роста графита.
В рамках этих представлений (изложенных, разумеется, весьма схематично) находят свое объяснение наблюдающиеся различия в кристаллизации алмаза и графита.
Так, при низких давлениях растет алмазный порошок. А возможен ли при этих условиях синтез из кристаллов алмаза другой формы?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'