
Выделение золота из руд
В настоящее время золотоносную руду подвергают размолу и затем обрабатывают металлической ртутью. Ртуть довольно быстро растворяет золото, образуя амальгаму. В амальгаме имеются соединения ртути и золота Au2Hg, Au3Hg, AuHg2 и др. Это примеры интерметаллических соединений - они тем прочнее, чем дальше в периоде расположены данные два металла друг от друга. Кроме того, содержатся и механически захваченные мельчайшие частицы - крупинки золота. Амальгаму фильтруют через замшу, и твердый остаток, где, кроме золота, есть и ртуть, подвергают перегонке, и ртуть улетучивается. Тонкие слои оксидов и сульфидов на поверхности золотых крупинок часто задерживают растворение металла в ртути, и в итоге при использовании ртутного метода заметная часть дорогого металла теряется.
Был разработан другой метод, в котором руду после размола подвергают действию при доступе воздуха раствора цианида натрия (его концентрация невелика и составляет приблизительно 0,2 % или меньше). Обработка продолжается от 6 до 48 ч при активном воздействии кислорода воздуха. К цианистым растворам прибавляют щелочи NaOH или Са(ОН)2 - они защищают цианид от гидролиза. В случае гидролиза - разложения цианида водой с образованием цианистого водорода и гидроксида натрия:
NaCN + H2O↔HCN + NaOH
создались бы условия для улетучивания HCN, что привело бы к потере цианистых соединений. Золото реагирует с цианидом по реакции, аналогичной той, которая приведена в главе о серебре:
2Au + 4CN- + H2O + 1/2O2 = 2[Au(CN)2]- + 2OH-
Физико-химический смысл этого процесса заключается в том, что ничтожное количество ионов золота Аu+ переходит в раствор и прочно связывается с ионами CN-, так что получается комплексный ион [Au(CN)2]-. Этот ион практически не диссоциирует на ионы золота и цианида. Поэтому после образования комплекса в растворе не остается ионов золота и ничто не мешает металлу снова перейти в раствор. Постепенно все золото из руды растворяется в избытке цианида. Без цианида малое количество ионов золота, перешедшее в раствор, образует насыщенный раствор и устанавливается равновесие между металлом и его ионами. Вследствие этого и дальнейшее растворение уже не может происходить. Для чего же нужен кислород? Дело в том, что переход ионов золота в раствор означает появление на металле отрицательного заряда. Этот заряд переходит на атомы кислорода. Ионы кислорода О2-, реагируя с водой, образуют два иона ОН-. Приведенное объяснение, конечно, схематично, процесс в действительности более сложен, но его суть заключается именно в сдвиге равновесия металл - ион металла за счет связывания золота в прочный комплекс. Если ввести в раствор комплекса металл, который заряжается сильно отрицательно (например, цинк), то отрицательно заряженные ионы комплекса будут разрушены. Ионы цинка сами соединятся с ионами CN-, а положительный ион золота разрядится на отрицательно заряженной поверхности цинка. Именно так и происходит при следующей производственной операции по выделению золота. В раствор цианидного комплекса этого металла вводят цинк в виде порошка или стружки, причем кислород предварительно удаляют:
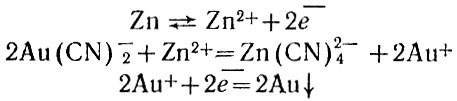
Осадок, содержащий золото, обрабатывают раствором серной кислоты (для удаления остатков цинка) и затем плавят. Полученное таким путем золото может быть дополнительно очищено.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'