
З
Закон действия масс
В 1867 г. норвежские химики К. Гульдберг и П. Вааге открыли химический закон действия масс.
Закон действия масс можно сформулировать так: скорость взаимодействия двух химических реагентов прямо пропорциональна их концентрациям в реакционной системе, а достижимое состояние химического равновесия зависит от скоростей прямой и обратной реакций (см. Обратимые реакции). Значит, в простом процессе: А + В = С + D прямая реакция, согласно этому закону, будет идти со скоростью v1 = К1 · [А] · [В], а обратная - со скоростью v2 = K2 · [C] · [D]. Равновесие в системе установится тогда, когда v1 = v2, и величину константы равновесия Кр можно в наиболее общем виде выразить отношением:
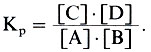
Сразу же возникает вопрос: а что такое К1, К2 и Кр? Кр - константа равновесия, Кр = = К1/К2, а К1 и К2 - константы скоростей прямой и обратной реакций. Константами их называют условно: постоянное значение они сохраняют только для данной реакции и при постоянных условиях ее проведения. Они не зависят от концентрации реагентов, но изменяются с изменением температуры. Химические свойства реагентов, температура, наличие катализатора и т.д. могут сильно влиять на величины К1, К2 и Кр, а значит, на скорость химической реакции и положение равновесия в системе. Например, при химическом синтезе аммиака по уравнению:
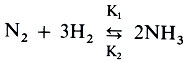
при комнатной температуре К1 > К2, а при 450°С - наоборот.
Анализ общего вида уравнения закона действия масс позволяет сделать несколько полезных выводов. Во-первых, для ускорения прямого процесса совсем не обязательно увеличивать концентрации обоих исходных веществ А и В, вполне достаточно взять большой избыток одного из них - того, которое дешевле и проще получить. Во-вторых, чтобы уменьшить скорость обратной реакции, можно воспользоваться удалением одного из продуктов, например испаряя его, убирая осадок и т.д. В-третьих, поскольку константы скоростей K1 и К2 зависят от температуры, есть возможность регулировать скорости реакций с помощью нагрева, охлаждения и т.д. И наконец, самое существенное: таким же образом можно повлиять на положение химического равновесия, т.е. на выход целевого продукта. Современное химическое производство успешно использует закон действия масс.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'