
Закон сохранения массы веществ и энергии
Настоящая наука отличается от произвольных наблюдений и случайных опытов тем, что научный результат всегда воспроизводим. Если ученый сообщил, в каких условиях воздействие на системы вызывает определенный результат, можно получить тот же результат, поставив опыт при тех же условиях.
Для химических экспериментов особое значение имеет соблюдение определенного температурного режима, чистоты исходных веществ, концентраций и порядка проведения реакции. При этом обычно предполагается, что объект исследования находится в той же инерционной системе (т. е. движется в пространстве с той же постоянной скоростью).
При проведении опытов химики используют основной закон природы - закон сохранения массы веществ: сумма масс исходных соединений равна сумме масс продуктов химической реакции. Первая общая формулировка этого закона была дана М. В. Ломоносовым в 1748-1760 гг.: "Все перемены, в натуре встречающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому. Сей всеобщий естественный закон простирается и в самые правила движения". В 70-х гг. того же века французский химик А. Лавуазье на основе многочисленных экспериментов доказал закон сохранения массы. А в 1840 г. основатель термохимии профессор Петербургского горного института Г. И. Гесс сформулировал закон сохранения энергии для химических реакций: "Тепловой эффект любой химической реакции зависит лишь от начального и конечного состояния системы и не зависит от промежуточных состояний и путей перехода".
Но можно ли применять эти законы, если реакция идет не в инерционных условиях? Например, как учесть соотношение масс и энергий космической ракеты, летящей в иную галактику, и газов, вылетающих из сопел ее двигателей (или фотонов, мезонов и т.д.)? В этом случае придется пользоваться более общим выражением закона сохранения массы веществ и энергии по уравнению А. Эйнштейна:
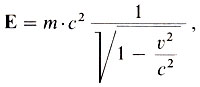
где Е - энергия тела, m - его масса, ν - скорость движения, с - скорость света в вакууме, равная 300000 км/с.
В земных условиях (особенно при проведении химических реакций при нормальных температуре и давлении) изменение массы настолько ничтожно, что мы его просто-напросто не можем обнаружить. Поэтому в лабораторной и производственной практике на каждом шагу пользуются законом сохране ния массы веществ в его классической форме
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'