
Чистое вещество и смеси
После краткого повторения о том, что узнали о физических свойствах веществ, учитель обращает особое внимание на свойства, которые можно определить количественно. По этим свойствам можно отличить какое-либо вещество от других веществ, но только в том случае, если оно чистое. А как узнать, чистое ли это вещество или смесь? Для этого изучают те его свойства, которые можно определить количественно, например плотность, температуру кипения, температуру плавления. Для ознакомления с тем, как изменяется плотность какой-либо жидкости при ее смешивании с другой жидкостью, можно показать опыт (рис. 1). В цилиндр наливают воды столько, чтобы оба поплавка не касались дна, а стрелка находилась против нулевого деления. Затем доливают крепкий сироп сахара, чтобы стрелка заметно отошла от нулевого деления.
На основе этих наблюдений учащиеся убеждаются в том, что чистая вода имеет постоянную плотность, принятую за единицу, а плотность растворов изменяется в зависимости от того, что растворено и какова концентрация раствора.
Затем следует сообщить, что для чистых веществ характерна постоянная, строго определенная температура кипения при одном и том же атмосферном давлении, а температура кипения смеси изменяется в зависимости от того, какие жидкости смешаны, в каких количественных отношениях находятся компоненты смеси. С этой целью можно продемонстрировать повышение температуры кипения водного раствора спирта. При этом нужно отметить начальную температуру кипения и ее повышение по мере удаления из смеси спирта. Так как показания термометра плохо видны учащимся, то рекомендуется заменить термометр термоскопом (рис. 13). Для этого в колбу емкостью 100-150 мл наливают около 50 мл чистого спирта и столько же воды, закрывают ее пробкой с двумя отверстиями. Через одно отверстие пропускают изогнутую газоотводную трубку, через второе - трубку термоскопа. Колбу с раствором спирта нагревают до кипения и отмечают уровень жидкости в термоскопе резиновым колечком, затем кипятят некоторое время и обращают внимание на то, что температура кипения раствора все время повышается. Затем нужно напомнить учащимся, что чистая вода тоже имеет постоянную температуру кипения (100°С) при нормальном атмосферном давлении, а температура кипения какого-либо раствора изменяется в зависимости от концентрации. Таким образом учащиеся знакомятся со вторым признаком, по которому различаются чистые вещества и смеси, - постоянная точка кипения чистого вещества и отсутствие ее у смеси.
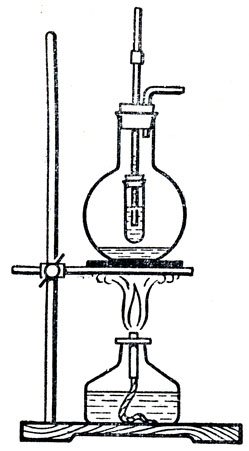
Рис. 13. Прибор для демонстрации постоянства температуры кипения чистых веществ
Говоря о температуре плавления смеси, можно привести такой пример: сливочное масло при нагревании сначала плавится лишь частично. Чтобы растопить весь взятый кусок масла, нужно нагреть его до более высокой температуры. Сливочное масло, как и всякий жир, является смесью и не имеет постоянной, определенной точки плавления. Плавление взятого образца начинается при одной температуре, а заканчивается при другой - более высокой. То же можно сказать и о парафине, температура плавления которого находится в пределах 50-60°С.
На этих примерах учащиеся не только усваивают понятия о чистом веществе и смеси, но и знакомятся с тем, как можно практически узнать, является ли данная жидкость (или твердое вещество) чистой или это смесь.
Как объяснить различие свойств чистого вещества и смеси
Чтобы ответить на этот вопрос, учащимся необходимо вспомнить то немногое, что они узнали о молекулярной теории на уроках физики (VI класс) в первом полугодии. Чтобы оживить в памяти учащихся эти знания, рекомендуется предложить им объяснить, пользуясь молекулярной теорией, почему при кипячении чистой воды температура кипения не повышается, если атмосферное давление не изменяется, почему температура плавления льда остается постоянной, как бы ни нагревали его. Опыт показывает, что учащиеся VII класса в начале обучения химии затрудняются ответить на этот вопрос. Поэтому у них появляется потребность посмотреть, что по этому вопросу написано в учебнике. Этим следует воспользоваться и организовать самостоятельные работы на уроке с учебником физики или химии.
В задании для самостоятельной работы можно написать следующие вопросы:
1. Как молекулярная теория объясняет строение твердых тел, жидкостей и газов?
2. Как изменяется скорость и характер движения молекул при нагревании твердых веществ и жидкостей?
3. Как объяснить переход веществ из одного физического состояния в другое?
4. Чем различается строение чистых веществ и смеси?
5. Почему чистые вещества имеют точки кипения и плавления, а смеси не имеют?
Применение самостоятельной работы на уроке вместо беседы рекомендуется потому, что при самой хорошей организации учебной работы на уроке-беседе все же активно участвуют в учебной работе далеко не все. Если же самостоятельную работу с учебником учащиеся проводят правильно, то каждый должен прочитать в учебнике то, что требуется, и подготовить ответ на каждый вопрос задания. Опыт такой работы в начале обучения химии показывает, что учащиеся еще недостаточно обучены самостоятельной учебной работе с книгой. Поэтому следует организовать эту первую работу с учебником химии так: каждый учащийся находит в учебнике ответ на первый вопрос задания и, записав его кратко в своей тетради, заявляет об этом учителю (поднятием руки). Когда большинство выполнит эту часть задания, тогда учитель проводит выборочную проверку (два-три ученика читают, что они записали в тетрадях). Учитель делает замечания, формулирует вместе с учащимися правильный ответ. Затем они переходят к решению второго вопроса задания. После окончания самостоятельной работы следует заслушать полные отчеты трех-четырех учащихся. При обсуждении этих отчетов учитель может исправить ошибочные или неточные ответы и внести необходимые дополнения.
Опыт взаимного проникновения газообразных веществ можно показать на примере диффузии в воздухе брома или двуокиси азота. При подготовке этого опыта нужно учесть, что обращение с жидким бромом небезопасно вследствие легкой его испаряемости и ядовитости паров. Поэтому рекомендуется переливание брома производить в вытяжном шкафу и пользоваться особой пипеткой с резиновым баллоном (рис. 14). В небольшой тигелек или фарфоровую чашечку нужно влить несколько капель брома, поместить тигелек или чашечку на стеклянную пластинку, густо смазанную вазелином, и накрыть цилиндром или стеклянной банкой, как указано на рисунке 15.

Рис. 14. Пипетка для взятия небольшого количества брома
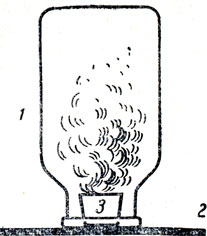
Рис. 15. Диффузия паров брома или двуокиси азота: 1 - стеклянная банка, 2 - стеклянная пластинка, смазанная вазелином, 3 - тигель с бромом
Выделяющиеся бурые бары брома довольно быстро распространяются по всему объему банки. Если нет жидкого брома, можно поместить в тигелек немного бромида натрия, смешанного с двойным количеством измельченной двуокиси марганца, прилить туда же концентрированной серной кислоты и накрыть тигелек с реагирующей смесью стеклянной банкой или цилиндром. Вместо этого опыта можно показать диффузию двуокиси азота. Для этого следует в тигелек под цилиндр положить медные стружки или опилки и прилить к ним несколько капель концентрированной азотной кислоты.
Во всех демонстрируемых опытах диффузии брома нужно выпускать пары брома из-под стеклянного колокола (или из-под банки) на воздух в вытяжном шкафу. В качестве примеров диффузии газов можно показать вещества, имеющие резкий запах: аммиак, диэтиловый эфир, грушевую эссенцию, нитробензол и т. п.
Труднее показать убедительные опыты для доказательства диффузии в жидкостях. Можно продемонстрировать опыт диффузии раствора марганцовокислого калия в воде (рис. 16). Для этого берут широкую стеклянную трубку, нижний конец ее закрывают пробкой, через которую проходит стеклянная трубка с краном. Можно вместо крана использовать стеклянную трубку, на которую надевают резиновую трубку с зажимом. Трудность подготовки этого опыта состоит в наполнении широкой трубки чистой водой и раствором марганцовокислого калия так, чтобы между этими жидкостями была хорошо видна граница. В начале опыта не наблюдается изменения этой границы. Но к концу урока учащиеся могут увидеть ее между бесцветной жидкостью (водой) и цветным раствором марганцовокислого калия. Трубку с двумя жидкостями следует оставить для наблюдений на последующих уроках. Но при всех условиях не следует затушевывать основную задачу урока - объяснение различий в свойствах чистых веществ и смесей на основе молекулярной теории. Результатом всего урока и заключительной беседы должно быть образование понятия о чистом веществе как совокупности одинаковых молекул, в отличие от смеси, состоящей из разных молекул. Таким образом, в понятии о веществе происходит первая дифференциация: образуются два понятия - чистое вещество и смесь.
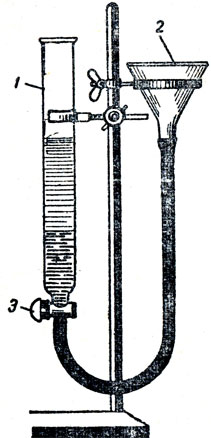
Рис. 16. Диффузия марганцовокислого калия: 1 - стеклянная трубка, 2 - воронка, 3 - кран
В содержании понятия "молекула" тоже происходят изменения: эти частицы получили различную качественную характеристику, обусловливающую различие свойств разных чистых веществ.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'