
Химические явления. Первоначальные сведения об атоме
Основной задачей обучения по этой подтеме является ознакомление с химическими явлениями и атомной теорией. Изучая химические явления в свете атомно-молекулярной теории, учащиеся знакомятся с ними путем наблюдений и с толкованием наблюдаемого как результата взаимодействия невидимых физических тел - атомов и молекул. В плане обучения по этой подтеме можно выделить следующие задачи:
1. Ознакомление учащихся с химическими реакциями и выяснение недостаточности молекулярной теории для их объяснения.
2. Первоначальное ознакомление со строением атома.
3. Типы химических реакций и объяснение их на основе атомно-молекулярной теории: реакции разложения, соединения и замещения.
4. Химические элементы и их международные обозначения.
Физические и химические явления
При первоначальном рассмотрении химических явлений необходимо обратить внимание учащихся на два существенных признака химических реакций: образование новых веществ в результате реакции и появление признаков того, что реакция сопровождается переходом энергии из одного вида в другой.
Для выявления первого существенного признака (глубокого изменения вещества) принято сопоставлять химические явления с физическими, имеющими сходные внешние признаки. Классическим примером таких демонстраций следует признать сравнение накаливания металла (магния) до яркого свечения с горением того же металла. Преимущество этого опыта перед другими демонстрируемыми для этой цели (нагревание стеклянной палочки и горение парафина) состоит в том, что, сравнивая накаливание двух металлов, учащиеся наблюдают свечение в каждом опыте, но конечные результаты этих процессов различны.
Не следует пренебрегать и менее эффектными опытами, например окислением медной пластинки или накаливанием медных опилок. Образующийся темный налет на поверхности металла показывает, что появилось новое вещество. Впечатление усиливается, когда учитель сравнивает этот налет с черным порошком окиси меди и сообщает, что и темный налет на металле и черный порошок - одно и то же вещество. Этот опыт доступен для выполнения его учащимися, они лучше могут рассмотреть темный налет окиси меди и сравнить с образцом этого вещества, выданным учителем.
Если учитель должен обратить внимание учащихся на энергетическую сторону химических реакций, то необходимо показать такие опыты, в которых реакции сопровождаются тепловыми, световыми, электрическими эффектами. При этом следует продемонстрировать как экзотермические, так и эндотермические реакции, не вводя этих терминов. Примером эндотермической реакции может служить разложение окиси ртути. Внешним признаком этой реакции, хорошо наблюдаемым учащимися, является выделение газа кислорода. При демонстрации этого опыта нужно обратить внимание на то, что газ выделяется только при нагревании (при поглощении энергии). Чтобы показать химическую реакцию, в результате которой появляется электрический ток, можно использовать упрощенную действующую модель гальванического элемента Вольта.
Для упражнения в применении полученных знаний о химической реакции можно рассмотреть несколько химических явлений, наблюдаемых в природе, в быту.
При ознакомлении учащихся с различными примерами химических реакций следует обратить их внимание на некоторые внешние признаки и связать их проявление с существенными признаками. Например, изменение цвета реагирующей смеси, выпадение из раствора осадка, выделение газа свидетельствуют об образовании нового вещества, а тепловые и электрические явления - об изменении энергии реагирующих веществ.
Первоначальные сведения об атоме
Формирование понятия об атоме представляет сложную методическую задачу, к решению которой учитель химии вынужден возвращаться несколько раз в течение всех лет обучения химии в средней школе. Наиболее сложным является первый этап формирования этого понятия, вследствие того что трудно выделить существенные признаки его. Из истории методики обучения химии известно два основных пути ознакомления учащихся с тем, что называется атомом. Первый сохранился от тех времен, когда в химической науке еще не утвердилась достаточно прочно атомно-молекулярная теория. Он связан с тем, что в результате изучения весовых отношении между реагирующими веществами был открыт закон химических эквивалентов (закон паев). Химический пай элемента определялся как наименьшее кратное из химических эквивалентов. Впоследствии пай, или паевой вес, стали называть атомным весом. Отсюда следовал вывод о том, что существуют частицы - атомы, отношения масс которых обозначает атомный вес.
Такой путь ознакомления учащихся с атомной теорией считается логически выдержанным. Он был принят в учебнике химии С. И. Созонова и В. Н. Верховского. Следовательно, при наиболее успешном продвижении учащегося по этому пути он приходил к ошибочному отождествлению разных понятий - атома и относительного атомного веса. Опыт показал, что учащиеся могли определять и понимать значение химического эквивалента элементов, но переход от этого понятия к атому оказался для них не по силам.
Второй способ изучения атомно-молекулярной теории был разработан коллективом квалифицированных учителей химии под руководством М. М. Попова и состоял в том, что учитель начинал с изложения "гипотезы" о молекулярном строении. Затем проверял ее на опыте и применял для объяснения некоторых физических явлений. После этого учащиеся приходили к выводу о том, что молекулы делимы и пределом их делимости являются атомы.
Последний способ после значительного упрощения был применен в учебной книге по химии для ФЗС Я. Л. Гольдфарба, Д. М. Кирюшкина и Л. М. Сморгонского, а затем был принят и автором первого стабильного учебника по химии В. Н. Верховским. Этот способ без значительных изменений сохранился и в современных учебниках по химии для VII класса. Сущность его состоит в том, что на основе изучения реакции разложения (окиси ртути) учащиеся убеждаются, что молекулы делимы. Затем учитель в соответствии с учебником сообщает учащимся, что существует предел делимости веществ при химических реакциях, что существуют химически неделимые частицы, которые называются атомами. Этот способ формирования первоначального понятия об атоме нельзя считать безупречным в логическом отношении. Атом определяется как частица, неделимая в химических реакциях, а химическими реакциями называются такие явления, при которых атомы не делятся. Чтобы избежать этой логической ошибки, нужно формировать понятие, обладающее другими существенными признаками.
При современном состоянии наук физики и химии и проникновении их во все отрасли народного хозяйства и быт основные понятия этих наук освещаются в популярной форме в печати, по радио и телевидению. Термины "атом", "электрон", "атомная энергия" вошли в словарь детей и взрослых. Первоначальные сведения о положительных и отрицательных зарядах учащиеся получают в V классе на уроке труда. Этих знаний учащимся достаточно для восприятия следующих первоначальных сведений об атоме: атом - мельчайшая частица вещества, состоящая из ядра, имеющего положительный заряд, и окружающих его электронов - частиц, имеющих отрицательные заряды. Заряд ядра равен сумме зарядов электронов, поэтому атом нейтрален. Указанные признаки являются общими для всех атомов. На основе такого описания атома у учащихся создается представление о нем как о реально существующей частице, которую нельзя воспринять нашими анализаторами, но можно представить по описанию. Это представление упрощенное, отличающееся от представлений ученых, все же нельзя считать неверным. Оно позволяет проще и доходчивее для учащихся разъяснить другие химические понятия: химический элемент, масса атома, атомная масса элемента.
Третий путь изучения атомной, а затем и атомно-молекулярной теории не описан в методической литературе, но по отдельным журнальным статьям можно судить о том, что в практике обучения химии он признается. Некоторые учителя первый урок на тему "Атом" проводят по следующему плану:
1. Недостаточность молекулярной теории для объяснения химической реакции.
2. Молекулы не самые простые частицы.
3. Атом - наименьшая частица вещества, но тоже сложная частица.
4. Объяснение реакции разложения с помощью атомной теории.
В вводной части урока в процессе повторения содержания предыдущего урока (на котором учащиеся узнали о химических реакциях) учитель предлагает объяснить химические реакции с помощью молекулярной теории. Наиболее соответствует цели урока ознакомление с реакцией разложения окиси ртути, так как оба продукта этой реакции известны учащимся: ртуть все видели в термометрах, о некоторых свойствах кислорода учащиеся узнали еще на уроках природоведения и ботаники. Самое же главное достоинство этой реакции с точки зрения цели урока заключается в том, что один из продуктов реакции (ртуть) состоит из атомов (одноатомных молекул). Недостаток опыта разложения окиси ртути состоит в том, что и окись ртути и ртуть - вещества ядовитые, и при неосторожном, неаккуратном обращении с ними могут произойти несчастные случаи. Поэтому он исключается из списка ученических, опытов.
Вследствие дефицитности окиси ртути и ядовитости ртути не рекомендуется проводить опыт с большим количеством этого вещества. При использовании малых количеств окиси ртути учащимся с их рабочих мест трудно наблюдать признаки реакции.
Опыт разложения окиси ртути можно провести в приборе, изображенном на рисунке 22. В пробирку помещают небольшое количество окиси ртути (около 5 г, или 0,5 см3). Стеклянная газоотводная трубка должна быть длинной, чтобы переброс воды из пневматической ванны в пробирку был затруднен. Демонстрацию этого опыта можно вести по второй форме сочетания слова учителя со средствами наглядности. Учитель обращает внимание учащихся на то, что окись ртути - чистое вещество, состоит из одинаковых молекул.
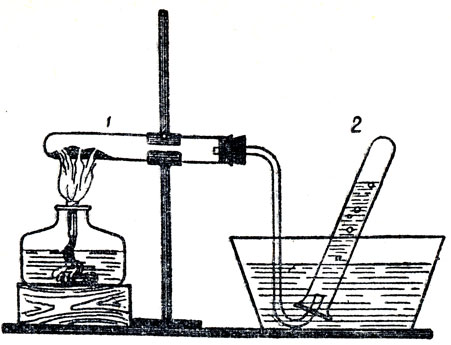
Рис. 22. Прибор для демонстрации разложении окиси ртути: 1 - пробирка с окисью ртути, 2 - пробирка для собирания кислорода
Наблюдая демонстрируемый учителем опыт, учащиеся прежде всего обнаруживают поступление какого-то газа в пробирку (или в цилиндр). При этом учитель обращает их внимание на то, что этот газ выделяется только при нагревания окиси, если же прекратить нагревание, прекращается и поступление газа в пробирку. Учитель предлагает учащимся выяснить, какой это газ. Они знают из курса ботаники, как обнаружить углекислый газ и кислород. По предложению учащихся учитель испытывает газ тлеющей лучинкой и обнаруживает, что собравшийся в пробирке газ - кислород. Делают вывод, что кислород получился из окиси ртути. Тогда возникает вопрос: что же осталось в пробирке, где находилась окись ртути? Учитель, показывает пробирку, разъясняет, что часть окиси ртути еще осталась, но на стенках пробирки появились капли ртути, которые издали увидеть трудно. Поэтому он проходит между рядами ученических столов и показывает капли ртути в пробирке. Чтобы сократить время для такого показа, можно привлечь к этому делу лаборанта, который покажет такую же пробирку с окисью ртути и каплями ртути второй половине класса. Обе пробирки перед показом следует закрыть пробками. После демонстрации учитель переходит к самой важной части урока - к анализу опыта на основе молекулярной теории и к определению понятия "атом".
При анализе результатов наблюдений учитель обращает внимание учащихся на то, что окись ртути - чистое вещество, состоит из одинаковых молекул, а после нагревания ее оказалось два вещества - ртуть и кислород. Сообщив о том, что и ртуть и кислород тоже чистые вещества и каждое состоит из одинаковых молекул, учитель предлагает объяснить учащимся разложение окиси ртути с помощью молекулярной теории. Учащиеся без затруднений делают вывод о том, что молекулы окиси ртути разложились и продуктом их разложения явились молекулы кислорода и ртути. Следовательно, молекулы окиси ртути - сложные частицы. Естественно возникает вопрос: могут ли молекулы кислорода и ртути дальше разлагаться? На этот вопрос рекомендуется ответить в форме исторической справки, что почти до конца прошлого века молекулы ртути считались неразлагаемыми. Из таких неразлагающихся частиц состоят: медь, железо, сера и другие вещества. Эти частицы были названы атомами. Слово "атом" в переводе с греческого языка на русский обозначает неделимый. Но теперь установлено, что и атомы могут дробиться при некоторых условиях, что атомы тоже сложные частицы. Затем следует краткое сообщение о строении атома в плане его определения. После того как сформулировано определение этого понятия, следует снова возвратиться к анализу реакции разложения окиси ртути.
Выяснение сущности этой реакции осложняется тем, что в конечном результате получаются не атомы, а двухатомные молекулы кислорода. Привести какие-либо доказательства двухатомное™ молекулы кислорода, доступные пониманию учащимися VII класса, не представляется возможным. Поэтому учителю остается догматически изложить теорию этого процесса, отметив в нем две стадии: образование атомов кислорода при разложении молекулы окиси ртути и объединение атомов кислорода в "двухатомные молекулы (рис. 23).
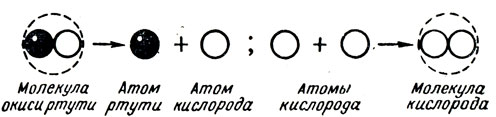
Рис. 23. Условное обозначение реакции разложения окиси ртути
Следующий урок рекомендуется провести на тему "Атомно-молекулярная теория". Учебные задачи этого урока:
1. Уточнение знаний учащихся об атоме, полученных на предыдущем уроке.
2. Краткие сведения о размерах атомов и молекул.
3. Обобщение изученного о строении вещества в форме основных положений атомно-молекулярной теории.
Первую часть урока рекомендуется провести в форме самостоятельной работы по заданию учителя, состоящему из пяти вопросов, которые можно написать на классной доске.

Таблица 8
Во второй части урока используются знания учащихся о размерах молекул, полученные в курсе физики VI класса. Эти знания могут быть дополнены другими примерами, например сравнением величин молекул водорода с величинами предметов из микромира. В заключение на этом уроке следует кратко обобщить сведения, полученные на уроках физики и химии об атомах и молекулах, и изложить основные положения атомно-молекулярной теории примерно в таком же объеме, как это дано в учебнике.
В порядке внеурочной работы можно предложить учащимся прочитать в "Книге для чтения" историю возникновения и развития атомной теории.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'