
Типы химических реакций
После того как учащиеся узнали, что такое атом, и ознакомились с атомно-молекулярной теорией, естественно следует закрепление и уточнение этих знаний. Важнейшим же способом усовершенствования знаний являются упражнения в их применении. В качестве таких упражнений следует рассмотреть в свете атомно-молекулярной теории три типа химических реакций.
В практике обучения химии часто переоценивают значение классификации химических явлений, не учитывая того, что могут быть и существуют классификации химических реакции по разным признакам, например: эндотермические и экзотермические, окислительно-восстановительные и реакции без изменения валентности элементов, участвующих в реакции. В старших классах после изучения строения атома и различных видов химических связей, учащиеся будут пользоваться классификацией, основанной на других признаках, хотя не исключается и классификация, которая основана на атомно-молекулярной теории. На данной ступени обучения важно не столько ознакомление с классификацией химических реакций, сколько изучение механизма их на основе атомно-молекулярной теории. Нет необходимости в формулировании определения разных типов реакций на основе их аналитических признаков. Достаточно формулировок терминов, встречающихся в атомно-молекулярной теории. В процессе изучения этих реакций учащиеся должны прежде всего научиться объяснять наблюдаемые ими явления, пользуясь этой теорией, приобрести умения выполнять простейшие химические опыты с познавательной целью.
В программе 1969 г. изучение трех типов химических реакций отнесено на конец первой темы. Но для формирования понятий "простое и сложное вещество", "химический элемент" необходимы знания учащимися реакций разложения, соединения и замещения. В конце же темы можно организовать практические занятия на эту тему с целью закрепления знаний и развития навыков.
В учебнике в качестве предпосылок к формированию этих понятий описывается только разложение окиси ртути, что явно недостаточно.
Реакции разложения
Учебные задачи обучения:
1. Формирование первоначального понятия о типе реакций разложения и об атоме.
2. Обучение применению знаний атомно-молекулярной теории к объяснению химических реакций.
3. Выявление связи между конструкцией и материалом, из которого построен прибор, и теми процессами, которые должны в нем протекать.
В учебнике химии для VII и VIII классов* на эту тему по первому вопросу в качестве основного признака понятия реакции разложения указывается количество веществ, вступающих в реакцию и получающихся в результате реакции. В соответствии с этой задачей организуют лабораторную работу разложения основной углекислой меди и обращают внимание на то, что до реакции было одно вещество, а в результате реакции получено три вещества (описание лабораторного занятия на стр. 98 и текст § 19, стр. 35 учебника, изд. 1969 г.).
* (См.: Ю. В. Ходаков и др. Неорганическая химия. Учебник для 7-8 классов. М., "Просвещение", 1969.)
Содержание и метод обучения на этом занятии проверен опытом многих учителей. Он пригоден для закрепления знаний. В методике обучения химии разработаны и уже применяются в педагогической практике на ту же тему такие уроки, на которых решаются более сложные и важные педагогические задачи, например: развитие понятия о реакции разложения на базе атомно-молекулярного учения, обучение применению знаний этой теории к анализу изучаемых явлений.
С этой целью на уроке применяют исследовательский учебный метод, это повышает педагогическую эффективность урока. Такой урок проводят по следующему плану:
1. Выяснение состояния знаний учащихся о реакции разложения окиси ртути.
2. Разъяснение цели данного урока.
3. Ознакомление с заданием для самостоятельной работы на тему "Разложение основной углекислой меди".
4. Самостоятельная лабораторная работа учащихся под руководством учителя.
5. Обсуждение результатов работы.
6. Формулирование определения реакции разложения на основе атомно-молекулярной теории.
7. Закрепление полученных знаний путем анализа примеров реакций разложения.
При выяснении знаний о реакции разложения окиси ртути следует иметь в виду предстоящую лабораторную работу, чтобы, повторяя изученное, готовить учащихся к выполнению нового задания. Прежде всего нужно напомнить учащимся, по каким признакам они обнаружили, что окись ртути действительно разложилась. Из указанных внешних признаков следует отметить изменение цвета и появление капелек ртути, появление кислорода в пробирке. Поэтому при изучении химических реакций нужно внимательно рассматривать исходные вещества, так как по их глубоким изменениям, превращениям можно заключить, что химическая реакция происходит. Затем следует вопрос: почему эту реакцию называют разложением окиси ртути? Учитель снова обращает внимание на внешний признак реакции: было одно вещество - окись ртути, а образовалось два - ртуть и кислород. И последний вопрос: как объяснить это явление с помощью атомно-молекулярной теории? Далее следует разъяснить цель новой лабораторной работы.
Учитель сообщает что реакции разложения происходят в природе, они же используются в производстве и в быту. На этом уроке учащимся предстоит самим произвести опыт разложения вещества, которое в химии называют основной углекислой медью, а в природе оно входит в состав минерала малахита. О том, как нужно производить опыт, написано в учебнике*. Прибор, в котором должна происходить реакция, дан в готовом виде. На основании сравнения веществ, вступивших в реакцию, и веществ, образовавшихся в результате реакции, нужно объяснить, почему эту реакцию называют разложением, и затем ответить на вопрос: какие химические реакции называются реакциями разложения? После такого вступления предлагается учащимся прочитать часть задания, а затем рассмотреть порошок малахита, кратко описать его внешний вид, внимательно рассмотреть прибор и проверить его герметичность. Так как эта работа представляет значительную сложность в техническом отношении, учителю следует проверить, как собраны приборы. После этого можно разрешить учащимся выполнять все задание и опять проверить результаты работы. Заключительную беседу надо провести по тем вопросам, которые поставлены в конце описания работы.
* (См.: Ю. В. Ходаков и др. Неорганическая химия. Учебник для 7-8 классов. М., "Просвещение", 1969, стр. 98.)
Можно применять и второй вариант лабораторной работы на ту же тему. Этот вариант применяется в том случае, если реакция разложения этой соли была рассмотрена на уроке и учащиеся узнали, какие вещества являются исходными, какие получаются в результате реакции и при каких условиях проходит эта реакция.
Отличие этого варианта от предыдущего состоит в том, что иначе осуществляется ознакомление учащихся с прибором, в котором происходит реакция. В предыдущем варианте прибор дается в готовом виде, без объяснения его устройства (даны лишь краткие указания, как обращаться с ним). Во втором варианте предусматривается выяснение соответствия конструкции прибора цели опыта и зависимости материалов, из которых приготовлены его части, а также устройства этих частей от условий химической реакции (см. главу III, часть I).
В результате такой беседы учащиеся должны понять:
1) почему детали прибора изготовлены из стекла, а не из металла (меди или железа);
2) почему нагревают исходное вещество в пробирке, а не в колбе или в стакане;
3) для чего нужна изогнутая стеклянная трубка;
4) зачем нужен стакан с известковой водой; почему с известковой, а не с чистой водой.
Благодаря такой беседе учащиеся установят причинно-следственную связь между устройством прибора, с одной стороны, и целью опыта, а также условиями осуществления этой реакции - с другой. Это позволит учащимся более сознательно пользоваться готовым прибором, усовершенствовать и изобретать приборы для осуществления известных реакций. Выполнение самой практической работы может проходить так же, как и в первом варианте.
Реакции соединения
Основная задача урока на тему "Реакции соединения" состоит в ознакомлении учащихся с одним из типов химических реакций. На этом уроке должны быть поставлены следующие задачи: 1) уточнение понятия о химической реакции; 2) закрепление знаний основных положений атомно-молекулярной теории; 3) приобретение умений применять ее при изучении химических явлений; 4) накопление учащимися знаний, необходимых для формирования первоначального понятия о химическом элементе.
В соответствии с этими задачами необходимо подобрать и дидактический материал, подготовить ученические опыты. Лучшим примером реакции соединения является взаимодействие серы с восстановленным железом. На этом опыте особенно наглядно видна разница между механическим смешением и химической реакцией соединения, так как учащиеся имеют возможность убедиться, что свойства веществ остаются прежними, если вещества только смешаны, если же происходит химическая реакция, то образуются новые вещества с новыми свойствами. Ученики невооруженным глазом могут видеть крупинки серы и железа в их смеси, а также обнаружить такое свойство железа, как притягивание к магниту, хотя железо и находится в смеси. В химическом же соединении серы и железа эти свойства не проявляются. Из свойств серы и железа, которые нужно изучать и затем обнаруживать в смеси, можно остановиться только на отношении их к магниту и к разбавленной соляной кислоте. Испытывать отношение этих веществ к воде (тонут они или плавают) не рекомендуется, так как учащиеся не знают еще о поверхностном натяжении жидкостей и о значении смачиваемости твердых тел.
При наличии в лаборатории достаточных количеств серы и восстановленного железа рекомендуется провести лабораторное занятие на тему "Реакция соединения серы и железа".
Эту лабораторную работу лучше проводить исследовательским методом, возможность и целесообразность применения которого в данном случае доказаны педагогическим экспериментом и опытом передовых учителей. Ввиду громоздкости этой работы необходимо на предыдущем занятии предложить учащимся приготовить дома таблицу записи отчета. Эта таблица должна заполняться на лабораторных занятиях после выполнения каждого опыта.

Таблица 9. Запись в ученической тетради
На этом занятии можно предоставить учащимся несколько большую свободу действия в сравнении с работой на тему "Очистка селитры", так как они уже приобрели некоторый опыт на первом лабораторном уроке. Все же при изучении свойств железа надо давать инструкции к каждой операции (описать внешний вид, узнать, притягивается ли магнитом, реагирует ли с кислотой) и проверять результаты ее выполнения. К опытам с серой достаточно дать одну общую инструкцию, сославшись на план изучения железа. Так же следует поступить и при изучении смеси серы с железом.
Для проведения реакции соединения нужно заготовить смесь в отношении: 7 вес. ч. железа к 4 вес. ч. серы - и поместить ее в небольшие узкие пробирки или стеклянные трубочки, запаянные с одного конца (получают их учащиеся перед опытом). Чтобы опыт прошел удачно, учителю нужно не только рассказать, но и показать, как это делать. При этом важно обратить внимание на экзотермичность этой реакции, требующей, однако, нагревания смеси на каком-либо участке для начала реакции.
При извлечении полученной спекшейся массы, состоящей главным образом из сернистого железа, следует предупредить учащихся, что разбивать пробирку (или трубку) нужно осторожно, завернув ее предварительно в бумагу, иначе можно получить ранение от осколков стекла. Перед испытанием полученной массы магнитом не следует ее растирать; учащиеся почти всегда обнаруживают, что часть измельченного порошка притягивается магнитом. Это явление надо объяснить тем, что не все железо соединилось с серой и притягиваются к магниту крупинки железа, увлекая и часть сернистого железа.
Следует предупредить учащихся о том, что для действия на сульфид железа надо брать небольшое количество кислоты (одну-две капли). В противном случае появление большого количества сероводорода в лаборатории нарушит нормальный ход работы и может возникнуть необходимость прекращения занятия.
После окончания всей работы учитель выборочно проверяет два-три отчета учащихся, а затем разбирает эту реакцию на основе атомно-молекулярной теории. В заключение можно показать опыт соединения серы с другими металлами, например с алюминием, с цинком. Но в этом случае нужно применять такое сочетание слова и средств наглядности, при котором эта демонстрация была бы для учащихся экспериментальной задачей. Учитель, показав порошок серы и цинка и смесь их, предлагает пронаблюдать опыт, а затем дать объяснение. В дополнение к тому, что наблюдали учащиеся, учитель должен сообщить, что соединяться могут не только атомы простых, но и молекулы сложных веществ в более крупные молекулы нового сложного вещества. В результате учащиеся будут подготовлены к определению химической реакции соединения: реакциями соединения называются такие реакции, в результате которых атомы или молекулы двух или более веществ соединяются и образуют молекулы более сложных веществ. Изученные реакции разложения окиси ртути и реакции соединения серы и железа полезно изображать схемами взаимодействия атомов и молекул, которые можно рисовать в виде кружочков или шариков или же просто писать названия - "атом железа", "молекула окиси ртути" и др.
Необходимо обозначить данный тип реакции в общем виде, для этого сравнивают реакцию соединения с реакцией разложения. Показать это можно так:
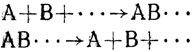
Реакции замещения
Ознакомление учащихся с реакциями замещения принято откладывать на более поздние сроки на том основании, что учащиеся якобы не могут разобраться в сущности реакций этого типа. Лишь при изучении водорода в силу необходимости приводится знакомить учащихся с реакцией замещения водорода в кислоте металлом. Такую точку зрения можно было бы признать до некоторой степени правильной тогда, когда изучение атомно-молекулярной теории начиналось после ознакомления учащихся с типами химических реакций. Если же рассматривать химические реакции в свете атомно-молекулярной теории, то нет оснований считать, что реакция замещения труднее для понимания, чем реакции соединения и разложения. Изучение же примеров реакции замещения обогатит учащихся знаниями, необходимыми для вывода определения химического элемента.
Знакомить учащихся с этим типом реакции при изучении темы "Водород" - значит загружать тему другими учебными задачами. Всякое же отклонение от обсуждения основного вопроса приводит к нечеткости изложения и ухудшению качества знаний учащихся.
Поэтому следует изучать реакции замещения непосредственно после разбора реакций соединения и разложения. В качестве примера реакции замещения можно рекомендовать вытеснение меди железом из раствора хлорной меди. Преимущества этой реакции состоит в том, что результаты ее легко обнаруживаются (изменение окраски раствора и появление налета меди на железном предмете, опущенном в раствор), и разбор реакции на основе атомно-молекулярной теории не представляет затруднений.
Урок на эту тему желательно провести в форме лабораторных занятий, так как ученические опыты, предназначенные для этой цели, проходят быстро и не требуют сложного оборудования. Но подготовка к работе должна быть проведена очень тщательно. Содержание вводного слова учителя зависит оттого, каким методом (исследовательским или иллюстративным) будут проводиться лабораторные занятия. Результаты экспериментальных уроков, проведенных на эту тему, позволяют рекомендовать один из вариантов исследовательского метода, который характеризуется тем, что выполнению опыта предшествуют теоретические предположения о результатах опыта, основанного на атомно-молекулярной теории. После повторения сведений о химических реакциях разложения и соединения учитель предлагает выяснить, как будет происходить взаимодействие простого вещества со сложным, например железа с хлорной медью. При этом он показывает кристаллическую хлорную медь, ее раствор и железные скрепки или гвоздики. Учащиеся решают вначале этот вопрос теоретически, а затем проверяют найденный ответ опытом.
Учитель рассказывает, что молекула хлорной меди состоит из трех атомов: одного атома меди и двух атомов хлора - и условно обозначает ее тремя соприкасающимися кружками; кружки, обозначающие атомы разных элементов, заштрихованы по-разному. Затем следуют четыре предположения о результатах встреч хлорной меди с атомами железа. Первое предположение - вещества не будут реагировать, тогда никаких признаков реакции не обнаружится. Второе предположение - произойдет реакция соединения хлорной меди с железом. В этом случае получится какое-то новое вещество, которое неизвестно учащимся и которого в лаборатории нет. Третье предположение - атомы железа соединятся с атомами меди и вытеснят атомы хлора. Учитель показывает колбу, наполненную хлором, и замечает, что, если такой газ появится, значит, третье предположение верно. Четвертое предположение - атомы железа вытеснят атомы меди и займут их место. Учитель показывает восстановленную медь и раствор хлористого железа. По этим признакам можно судить о правильности последнего предположения.
Благодаря такому вводному слову учителя исследовательский метод проявляется в том, что учащиеся, проводя наблюдения с определенной и ясной для них целью, открывают неизвестный им ранее факт. Составление предварительных теоретических предположений оказывает организующее влияние на ход их исследования, подобно тому как хорошо разработанная гипотеза в научном исследовании способствует более целенаправленной поисковой деятельности ученого.
Учащиеся в данном случае ждут не каких угодно, а определенных результатов. Интерес учащихся в этом случае особенно сильно повышается. Появление красного налета на железных изделиях вызывает неподдельную и нескрываемую радость учащихся.
В дополнение к рассмотренной реакции замещения меди железом можно показать и другие примеры реакций этого типа, например вытеснение цинком свинца из его соли, медью серебра из раствора азотнокислого серебра и т. д. Разбирать подробно эти реакции нет необходимости. Достаточно обратить внимание на вытеснение одного металла другим из растворов солей. Эти опыты может демонстрировать учитель как экспериментальные задачи. Реакцию замещения можно иллюстрировать, как показано на рисунке 24. В обобщенном виде ее изображают в виде схемы:
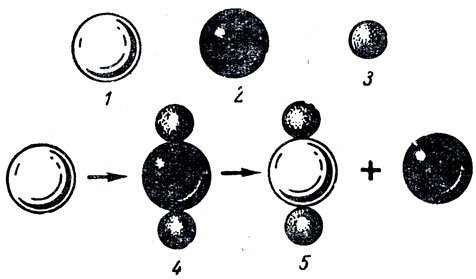
Рис. 24. Условные изображения атомов и молекул: 1 - железа, 2 - меди, 3 - хлора, 4 - хлорида меди, 5 - хлорида железа
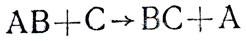
где АВ - сложное вещество, участвующее в реакции, С и А - простые вещества, ВС - вновь полученное сложное вещество.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'