
Основные законы химии. Химический язык
Закон постоянства состава
Во вводном курсе химии изучаются два основных закона химии: закон сохранения масс и закон постоянства состава. Несмотря на то что закон постоянства состава является основным законом химии и его открытие способствовало развитию химии, методика изучения его слабо разработана, а одно время он был исключен из программы по химии для средней школы. Авторы программы объясняли исключение закона тем, что он не усваивается учащимися. Такое заключение сделано на основании анализа контрольных письменных работ, проведенных в школах. В этих работах на вопрос, требующий сформулировать закон, многие учащиеся формулируют вместо него закон сохранения массы. Но из этого совсем не следует, что учащиеся не понимают сущности закона постоянства состава. Они просто забыли его определение, хотя пользовались им на каждом уроке, когда писали химические формулы. Но при ошибках написания формулы какого-либо вещества учитель обычно не отмечает нарушения этого закона, а обращает внимание учащихся только на валентность какого-либо элемента. Из этого факта делается ошибочное заключение о том, что можно не изучать закон постоянства состава, достаточно знать валентность. Но учение о валентности представляет собой лишь теоретическое истолкование этого закона, без изучения которого теория валентности лишается доказательности и остается всего лишь гипотезой. Знание этого закона необходимо так же для характеристики химических соединений и отличий их от смесей и растворов.
Усвоение этого закона проходит более успешно, если учащиеся предварительно узнали о том, что химические элементы соединяются не в произвольных, а в определенных количественных отношениях их масс. Ознакомиться с этой особенностью (тоже законом) учащиеся могут на примерах известных им химических реакций, рассмотрев их с количественной стороны. При этом важно отметить, что химические реакции могут начаться, если исходные вещества смешаны в любых количественных отношениях, но соединяются элементы или замещают друг друга лишь в определенных отношениях их масс. Эту закономерность можно показать на примерах реакции соединения серы и железа, беря их в разных отношениях и отмечая, что при всех пропорциях смеси сера и железо соединяются в отношении 4:7.
В качестве примера реакций замещения для иллюстрации той же закономерности надо рассмотреть взаимодействие железа с раствором хлорной меди. Можно отметить, что реакция замещения происходит, если в большое количество раствора хлорной меди опустить небольшой железный предмет. Происходит она и в том случае, если поместить каплю этого раствора на железную пластинку. Но во всех случаях 7 вес. ч. железа замещают 8 вес. ч. меди.
Переходя к изучению закона постоянства состава, следует разъяснить значение терминов: качественный состав, количественный состав, атомный состав. Затем при сравнении состава веществ следует подчеркнуть, что речь идет о чистом веществе. В методике изучения закона постоянства состава могут быть два подхода: дедуктивный и индуктивный. При дедуктивном подходе можно предвидеть этот закон, пользуясь атомно-молекулярной теорией и зная атомные массы элементов. Так как молекулы чистого вещества одинаковы, то можно предположить, что и атомный состав их одинаков. Вследствие того что атомные массы элементов постоянны, количественный состав чистого вещества тоже должен быть постоянным. Этот вывод должен быть проверен и при этом рассмотрен состав нескольких чистых веществ. После этого можно кратко рассказать историю открытия закона постоянства состава, отметить огромное количество анализов, проведенных многими учеными (особенно Прустом и К. Бертоле) для решения вопроса, является ли состав какого-либо вещества постоянным, если образцы его взяты из разных мест нашей планеты или получены они искусственно разными способами.
Этими опытами был решен вопрос положительно и тем самым открыт закон природы, который можно формулировать так: всякое чистое вещество имеет постоянный состав, независимо от места его нахождения и способов получения.
При индуктивном подходе к изучению этого закона учитель начинает с постановки вопроса: является ли состав чистого вещества постоянным или он изменяется в зависимости от места нахождения или способа получения изучаемого чистого вещества.
Для ответа на этот вопрос учитель может сообщить, что результаты самого точного количественного анализа чистой воды, взятой из разных мест нашей планеты, показали, что все образцы воды имеют одинаковый состав, если она освобождена от всяких примесей.
При ознакомлении с разногласиями относительно постоянства состава веществ между двумя учеными - Прустом и К. Бертоле нужно указать на основную причину этих разногласий, состоящую в том, что К. Бертоле не очень тщательно проводил очистку изучаемых веществ. Поэтому у него получались различные результаты анализа одних и тех же веществ.
После ознакомления учащихся с законом постоянства состава следует возвратиться к анализу содержания понятий: молекула, чистое вещество, смесь. Затем представляется возможность уточнить признаки молекулы как самой маленькой частицы вещества: она обладает химическими свойствами и составом всего чистого вещества.
На основании закона постоянства состава устанавливается еще один признак чистого вещества, отличающего его от смеси: состав чистого вещества постоянен.
Химический язык
Когда учитель химии характеризует подготовку учащихся по своему предмету, он прежде всего отмечает их умение или неумение писать химические формулы и уравнения. Эти же показатели имеют большое значение при оценке подготовленности учащихся на выпускных экзаменах в средней школе и на приемных экзаменах в вузе. В процессе обучения химии от учащихся все время требуют знания формул и умения правильно составлять уравнения химических реакций. Однако чрезмерное увлечение химическим языком часто приводит к своеобразному формализму. Вследствие этого химический язык из средства, облегчающего обучение химии, превращается в цель, достижение которой требует иногда непосильной, бессмысленной зубрежки. Поэтому безошибочное писание формул не всегда может служить показателем хороших знаний химии.
Вот почему нужно осторожно и продуманно вводить в обучение химии химический язык. Прежде всего необходимо довести до сознания учащихся, что химические формулы и уравнения являются не целью обучения химии, а средствами для краткого обозначения состава вещества или для объяснения химического явления. Нужно на примерах показать удобство обозначения химической формулой атомного состава данного вещества и кратко записать его. Поэтому рекомендуется особенно в начале ознакомления с химическим языком требовать от учащихся чтения формул так, чтобы вначале они называли количества атомов и названия элемента и лишь после этого читали формулу на "химическом языке".
Обучение химическому языку можно разделить на три части: ознакомить учащихся с химическими знаками, после того как они узнают, что называется химическим элементом, после рассмотрения закона постоянства состава познакомиться с химическими формулами, а уже затем с химическими уравнениями.
Изучать химические формулы следует начинать с обозначения молекул, атомный состав которых известен учащимся, например: сернистое железо, окись ртути, окись меди, хлорная медь и т. д.
В качестве наглядного пособия можно использовать таблицу, содержащую формулы известных учащимся веществ с изображением их молекул и атомов в виде кружков (рис. 25) или в объемном изображении, как в учебнике химии. Желательно поместить на этой же таблице и образцы веществ, обозначенных формулами. Пользуясь этой таблицей или записывая на классной доске химические формулы известных учащимся веществ, учитель обучает учащихся чтению формул, отмечает, что химическая формула показывает, какие и сколько атомов входят в состав молекулы данного вещества. Наконец, следует провести упражнения в составлении химических формул веществ, атомный состав которых дан. При этом должно быть обращено внимание учащихся на различие значений чисел, обозначающих коэффициенты и индексы. Во избежание недоразумений следует отметить, что каждой формулой обозначается лишь одна молекула вещества. Поэтому нельзя говорить: "Мы взяли аш-два-о", так как нельзя взять одну молекулу воды или другого какого-либо вещества.
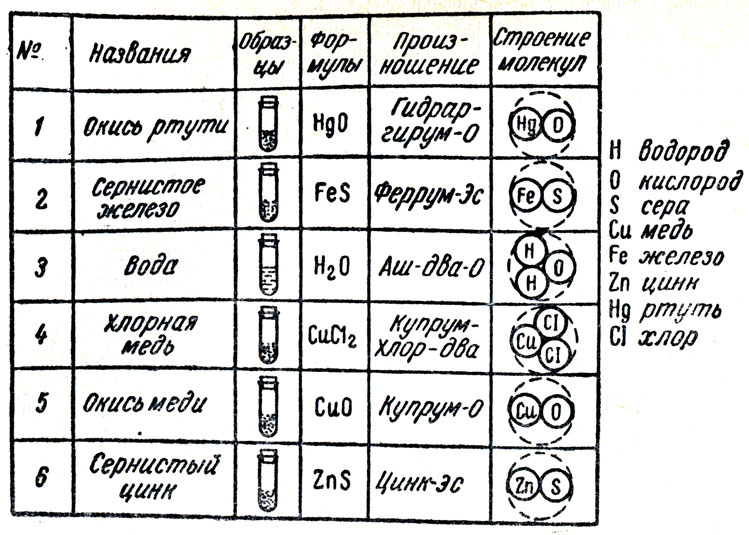
Рис. 25. Пособие для первоначального ознакомления учащихся с химическими формулами
Первоначальному ознакомлению с химическим языком достаточно отвести один-два урока, помня, что в дальнейшем учащиеся будут пользоваться им на каждом уроке при разборе химических реакций на основе атомно-молекулярной теории. Во всех случаях не следует увлекаться упражнениями, тренирующими учащихся писать формулы неизвестных им веществ. Важно помнить, что химический язык не цель изучения химии, а средство нужного истолкования химических явлений.
Вопросы о содержании и методике обучения по теме "Валентность" в VII классе были предметом дискуссии на страницах журнала "Химия в школе". Обсуждались вопросы: на каком теоретическом уровне надо изучать валентность, каков объем знаний о валентности должны получить учащиеся, когда нужно изучать валентность?
Большинство авторов, принявших участие в дискуссии, высказалось за то, что в VII классе следует изучать валентность на базе атомно-молекулярной теории, так как изучение всех тем программы проходит на этой теоретической основе. С этими высказываниями следует согласиться. Валентность должна рассматриваться как свойство атомов присоединять или замещать то или иное количество атомов другого элемента. Таким образом, понятие "валентность" отграничивается от понятия "химическая связь" и включает только количественное значение изучаемого свойства химических элементов. Для уточнения круга знаний о валентности и умений их применять следует руководствоваться тем, что учение о валентности, как и всякая теория, должно помочь изучающему химию объяснять и предвидеть факты.
На основе знания валентности весьма убедительно объясняется закон постоянства состава. Без этого объяснения закон был бы загадкой. С другой стороны, само учение о валентности, а следовательно, и атомно-молекулярное учение опирается на этот закон. Если бы не был открыт закон постоянства состава, учение о валентности было бы только гипотезой. Этим по существу и ограничивается возможность объяснения чего-либо на основе знаний валентности в VII классе. Всякие попытки качественной характеристики валентности приводят к необходимости изучать электронную теорию строения атома и на этой основе изучать виды химической связи.
Не менее важно уточнить, что может учащийся VII класса предвидеть на основе усвоения понятия о валентности. Важно это потому, что на практике часто переоценивают эти возможности и не различают усвоение понятия о валентности и знание конкретных фактов, на основе которых выявляется валентность того или иного элемента.
Такие ошибки происходят по двум причинам: во-первых, потому, что учащиеся не выучивают валентность некоторых элементов, с которыми им приходится иметь дело, во-вторых, потому, что этот круг знаний валентности не ограничивается учителем, и учащимся предлагается "угадать" валентность таких элементов, которые не изучались. Завышенными являются также и требования составлять на основе знаний валентности формулы сложных веществ, состоящих из трех или более элементов. Например, учитель требует, чтобы учащийся написал формулу серной кислоты, и сообщает валентность кислорода, водорода и серы. Учащийся ошибается (пишет H2SO2). Чья ошибка в данном случае? Конечно, ошибся учитель, предложив такой вопрос, который нельзя решить, если взять только валентность элементов, образующих это соединение, и не знать, как соединяются атомы в молекуле серкой кислоты. По той же причине учащиеся, пользуясь только знаниями валентности, находят, что азот в азотной кислоте семивалентен, а сера в серной кислоте десятивалентна. На основе тех знаний, которыми располагают в это время учащиеся, они правильно производят подсчеты, полагая, что в молекуле серной кислоты все атомы соединены с атомом серы, а в молекуле азотной кислоты все атомы соединены с атомом азота.
К завышенным требованиям следует отнести составление структурных формул для сложных веществ, состоящих более чем из двух элементов, если строение молекул этих веществ еще не изучено и не обосновано. При ознакомлении со структурными формулами окислов и соединений, состоящих из двух элементов, следует рассматривать линии, соединяющие химические знаки как обозначения единиц валентности, а не как линии химической связи, показывающие порядок соединений между атомами.
Учитывая теоретическую подготовку учащихся VII класса, можно определить круг знаний и умений учащихся по теме "Валентность": они должны знать и сознательно формулировать определение валентности, уметь определить валентность какого-либо элемента по формуле его окисла и составить формулу окисла, если известна валентность этого элемента. Те же требования можно предъявить и в отношении других веществ, состоящих из двух элементов. Зная валентность металла, учащийся должен правильно написать уравнение реакции замещения металлом водорода или другого металла, валентность которого известна.
Дискуссионным остается вопрос о том, в какой части вводного курса следует знакомить учащихся с валентностью. Одни стремятся ознакомить учащихся с валентностью возможно раньше, чтобы применять эти знания в процессе обучения большей части курса химии. Другие, не видя большого практического значения в этих занятиях, относят изучение валентности в самый конец обучения химии в VII классе, когда учащиеся начнут изучать окислы, основания, кислоты и соли. При этих условиях у учащихся накопится достаточный запас знаний, фактов, механизмов, чтобы они с большей самостоятельностью и осознанностью приобретали знания о валентности. В первом случае переоценивается, а во втором недооценивается значение знаний о валентности. И ни то ни другое решение вопроса не учитывает внутренней связи между законом постоянства состава и теоретическим объяснением его. Чтобы учащиеся осознали эту связь, следует рассматривать валентность непосредственно за изучением закона постоянства состава, как продолжение его изучения.
Если этот закон изучается рано, то полное изучение валентности осложняется тем, что учащиеся накопили еще мало знаний о составе веществ. В этом случае следует изучение валентности разделить на несколько этапов. На первом этапе понятие "валентность" используют для объяснения закона постоянства состава и определенных весовых соотношений между химическими элементами. Определение этого понятия формулируется так: "Свойства атома какого-либо элемента присоединять (удерживать) определенное (а не произвольное) количество атомов другого элемента называется валентностью". Этот вывод делается на основе изучения атомного состава изученных учащимися веществ. Чтобы ознакомить учащихся с единицей измерения этого свойства атомов, следует рассмотреть атомный состав веществ: воды, сероводорода, аммиака. Учитель, обратив внимание учащихся на то, что атомы водорода не удерживают больше одного атома любого элемента, сообщает, что валентность водорода принята за единицу измерения валентности. По атомному составу воды и сероводорода учащиеся находят валентность кислорода и серы. По валентности этих элементов определяют валентность других.
При изучении кислорода понятие о валентности расширяется: учащиеся узнают о существовании элементов с постоянной и переменной валентностью, о том, что наибольшая валентность равна восьми. На следующем этапе учащиеся узнают, что при изучении водорода валентность можно определить на основе анализа реакций замещения водорода металлами, это находит изменение в формулировке определения понятия о валентности.
При изучении воды и оснований учащиеся знакомятся с валентностью группы атомов - гидроксилом, а при изучении кислот - с валентностью кислотных остатков. Такое расчленение изучения валентности представляет некоторые методические трудности. Преимущество же этого способа состоит в том, что формирование понятия на каждой ступени не навязывается учащимся, а возникает из потребности более глубокого познания молекулярной теории и применения ее для объяснения и предвидения факта. Благодаря такому изучению теории увеличивается интерес к приобретению знаний.
Изложенные выше методические соображения относятся к способу изучения валентности как части атомно-молекулярного учения о строении вещества. А можно ли и нужно ли изучать валентность в вводном курсе химии на основе тех представлений о строении атома, которые формируются у учащихся на этой ступени обучения? Этот вопрос важен потому, что сама постановка вопроса о более раннем изучении строения атома возникла благодаря тому, что учителей не удовлетворяет истолкование этого свойства на основе атомно-молекулярного учения. Желание связать это свойство со строением атома объясняет настойчивые попытки учителей и некоторых авторов учебников ознакомить учащихся с видами химической связи, объединив это новое понятие с понятием валентности. Но при реализации этих намерений встречаются большие трудности, вследствие того что теория химической связи оказалась сложной и в ряде случаев противоречивой. Упрощенные же решения этой методической проблемы приводят к научным ошибкам. Одной из них является сведение всех видов связи к одной ионной связи. Но это противоречит основному дидактическому правилу: нельзя сообщать неверных сведений, хотя бы и ради доступности усвоения сложного учебного материала.
Возникает методическая задача определения предела доступности содержания понятия о химической связи, позволяющего объяснить учащимся VII класса валентность на основе строения атома. Если все виды химической связи нельзя сводить к одному виду, который может быть в какой-то мере усвоен учащимися, тогда остается только сообщить, что при химическом взаимодействии атомы сближаются настолько, что происходит перегруппировка электронов в их наружных слоях. В зависимости от того, какое количество электронов какого-либо атома участвует в этой перегруппировке, проявляется и валентность данного элемента.
Но возникает снова вопрос: какое применение могут найти эти знания в изучении вводного курса химии? Можно ли с их помощью объяснить или предвидеть какие-либо явления? Ответ может быть пока отрицательный. Следовательно, при современном состоянии методики обучения химии ознакомление учащихся с электронной теорией валентности не может проходить с той глубиной, которая позволяет широко пользоваться этой теорией для истолкования и предвидения фактов. Лишь в самом общем виде можно сообщить учащимся о зависимости валентности от количества электронов, участвующих в процессах химического взаимодействия атомов. Можно сообщить учащимся, что о более подробном изучении валентности они узнают в следующем классе. Теперь же сообщение этих общих сведений преследует профилактические цели: предупреждение образования неверных представлений у учащихся о строении атома и валентности на основании плохо организованного чтения не всегда хорошей научно-популярной литературы или слушания передач по радио и телевидению.
Закон сохранения массы веществ
К настоящему времени в методике обучения химии выявились два варианта изучения закона сохранения массы веществ. Они различаются по сложности педагогических задач и по методике изложения.
В первом варианте педагогические цели ограничены частно-методическими задачами: учащиеся должны понять и усвоить этот закон только как химический закон. В методике изложения отдано предпочтение историческому подходу перед дидактическим. Попытка вывести этот закон как следствие из основных положений атомно-молекулярной теории оказалась не очень удачной. Химические опыты, которые должны иллюстрировать выводы, примитивны и недостаточно наглядны.
Опыты, которые описаны в некоторых учебниках и в методических пособиях, малоубедительны, так как рекомендуемые для демонстрации реакции внешне сходны с механическим перемешиванием исходных веществ, а самые процессы и их результаты также трудно наблюдать учащимся.
При изучении этого закона после изучения кислорода и воздуха можно избежать указанных недостатков, но в этом случае приходится отложить обучение учащихся письму и чтению химических уравнений.
В новом учебнике принят первый способ, применяя который учитель быстро и просто знакомит учащихся с этим законом. Методика этого урока очень проста. В основу ее положено описание исторического опыта М. В. Ломоносова.
Значительно сложнее второй вариант изучения этого закона, но и педагогические задачи урока более значительны. Учащиеся, изучающие этот закон по второму способу, должны понять и усвоить, что законы природы существуют независимо от того, знают ли их люди или не знают, что наши знания законов природы все время углубляются, приближаясь к истине, и зависят от общего состояния наук, от методов научного исследования, техники эксперимента. При изучении закона сохранения массы веществ следует обратить внимание учащихся на то, что открытие его подрывает основы религии: веру в сотворение мира из ничего и другие чудеса. Обстоятельное изучение химических законов должно оказать большое влияние на формирование у учащихся материалистического мировоззрения. При разработке методики изложения этой темы необходимо учесть, что закон сохранения массы веществ рассматривается в курсе химии два раза: в VII классе, на основе атомно-молекулярной теории, и в старших классах, когда изучаются ядерные реакции.
При изучении строения атомного ядра и ядерных реакций на уроках физики и химии затрагивается вопрос о взаимосвязи массы и энергии. При этом учитель может испытывать трудности на уроках химии, происходящие от различного понимания этого закона учащимися VII и старших классов. Если учащиеся VII класса восприняли этот закон как всеобщий, применимый без каких-либо ограничений ко всем явлениям и абсолютно точный, то в IX классе (а по физике в X классе) они вынуждены будут признать эти взгляды противоречащими установлению зависимости массы от скорости движения.
Кроме того, метафизический подход к изучению этого закона ведет еще к одному весьма серьезному осложнению. Учащиеся старших классов, узнав о том, что изменение энергии связано с изменением массы реагирующих веществ, склонны отрицать практическое значение закона на том основании, что всякая химическая реакция сопровождается выделением или поглощением энергии, а следовательно, и увеличением или уменьшением общей массы реагирующих веществ. Они не принимают во внимание того, что величина изменения массы при химических реакциях ничтожно мала.
Во избежание недоразумений необходимо вести изучение этого закона так, чтобы учащиеся видели в нем важнейшее обобщение, соответствующее определенному состоянию науки. С самого же начала изучения этого закона учащиеся должны понять, что не все познано наукой в данной области, что могут и должны быть открытия, углубляющие наши знания, что изучаемый закон верен в пределах точности современных способов взвешивания и применим к большому кругу явлений, но не ко всем. В законе эквивалентности массы и энергии учащиеся должны видеть не отрицание закона сохранения массы веществ, а дальнейшее его уточнение, ограничение областей его применения. Для правильного понимания учащимися этого закона, как и других законов природы, необходимо выявить роль практики в проверке правильности и применимости законов.
С этой точки зрения открытие закона сохранения массы веществ, основанное на точных количественных исследованиях, сохраняет свою ценность, так как в пределах точности это определение закона остается верным и широко применимым. Все это требует серьезного подхода учителя к методике изучения этого закона в VII классе, чтобы, допуская усвоение неполных знаний, не допускать усвоения неверных знаний.
Методика обучения по второму варианту усложнена и самим ходом учебного процесса, что видно из предлагаемого плана.
1. Вводная беседа: постановка вопроса и план его решения.
2. Экспериментальное доказательство закона.
3. Ознакомление с работами выдающихся ученых.
4. Научное и практическое значение закона.
Основной задачей вводной беседы первого урока является постановка вопроса темы и указание пути его решения.
Следует заметить, что принцип неуничтожаемое™ материи признавали еще натурфилософы древнего мира как само собой понятное философское положение. Лишь более глубокое изучение химических явлений заставило задуматься людей науки над тем, возможно ли применять этот принцип в отношении массы реагирующих веществ. Не случайно, что закон сохранения массы был экспериментально обоснован в результате химических исследований М. В. Ломоносовым (и другими учеными-химиками).
Если ученые-естествоиспытатели на заре молодой науки химии проходили мимо основного закона химии, то без надлежащего разъяснения учителя нельзя требовать глубокого понимания этого закона от начинающего изучать химию. Нужно помочь учащимся задуматься над этим вопросом, подготовить их к предстоящему его изучению. Для этого следует вспомнить, в чем отличие химических реакций от физических изменений, еще раз рассмотреть химические явления в свете атомно-молекулярной теории, обратить внимание учащихся на поглощение или выделение энергии при химических реакциях, а затем поставить вопрос: изменяется ли масса атомов при разрушении одних молекул и образовании других? Не становится ли общих масс образующихся при реакции Веществ больше или меньше общей массы веществ, вступивших в реакцию, если последняя идет с выделением или поглощением энергии? Как только удастся возбудить интерес учащихся к поставленному вопросу, следует наметить план его решения. Во многих учебниках принят исторический подход при изучении этого закона. Не отрицая значения историзма в преподавании химии, в особенности в данной теме, все же следует признать более Правильным с дидактической точки зрения другой путь, а именно от Непосредственных наблюдений учащимися химических опытов в Классе к изучению работ ученых-химиков по этому вопросу.
В учебной и методической литературе предлагается большой выбор химических опытов для доказательства закона сохранения массы веществ. Но среди них мало простых и убедительных опытов, а некоторые из них приводят даже к противоположным на первый взгляд результатам. Например, наблюдение горения свечи на весах показывает либо уменьшение веса (если не поглощают продукты реакции), либо увеличение (в случае их поглощения).
При нагревании металлов в закрытых пробирках со взвешиванием их до и после опыта вес их не изменяется. Но этот опыт не является убедительным, так как трудно обнаружить изменение внешнего вида металлов и доказать, что реакция действительно произошла. Если же какими-либо способами будет доказано окисление металлов в пробирках, то учащиеся не могут быть уверены в том, что они учтут возможность изменения веса, взвешивая на школьных весах такие малые количества кислорода, которые соединяются с металлами в пробирках. Нельзя признать удачным применение для доказательства существования закона сохранения массы веществ и опыта разложения углемедной соли со взвешиванием исходных веществ и продуктов реакции. Дело в том, что в той постановке, в какой рекомендуется проводить этот опыт, продукты реакции (углекислый газ и водяные пары) не поглощаются полностью натронной известью, помещенной в хлоркальциевой трубке. Поэтому при взвешивании прибора на технохимических весах всегда обнаруживается, что вес веществ, полученных в результате реакции, меньше веса веществ, вступивших в реакцию. Малоубедителен и опыт взвешивания двух растворов до их смешивания и наблюдение равновесия после того, как эти растворы сольют вместе. Этот опыт не возбуждает каких-либо вопросов и сходен больше с простым смешиванием двух веществ, а не с химической реакцией.
Для доказательства справедливости закона сохранения массы веществ нужно демонстрировать реакцию, сопровождающуюся тепловым и световым эффектом, чтобы эта реакция проходила в закрытом сосуде, чтобы количества реагирующих веществ и продуктов реакции можно было определить с помощью технохимических весов.
Для этого надо взять склянку (рис. 26) емкостью около одного литра и подобрать к ней резиновую пробку, через которую пропущена ручка от железной ложечки и металлический стержень, соединенный с отрезком спирали от электрической плитки. И стержень и ручка присоединяются проводами к источнику тока. В качестве реостата можно включить последовательно в электрическую цепь обыкновенную электрическую плитку. Сжигать можно красный фосфор, серу, магний. Разумеется, перед уроком нужно проверить выполнение этого опыта, заготовить запасную короткую нихромовую спиральку на случай, если перегорит спираль, соединяющая металлический стержень с железной ложечкой, в которую помещают перед опытом горючее вещество. Сжигание нужно проводить в воздухе, а не в чистом кислороде, так как при горении магния или фосфора в чистом кислороде происходит слишком сильное разогревание газов, что ведет к сильному газовому давлению внутри склянки, которая может не выдержать этого давления.
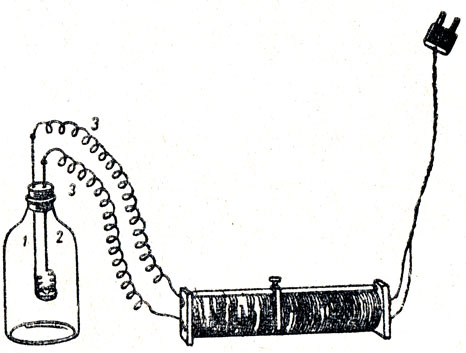
Рис. 26. Сжигание веществ в закрытом сосуде: 1 - широкогорлая склянка, 2 - железная ложечка с нихромовой спиралью, 3 - электрические провода
Если в качестве основного метода изучения этого закона был принят метод исследовательский, то демонстрации описанного опыта должно предшествовать вводное слово учителя, в котором он предлагает решить такой вопрос: изменяется ли вес атомов в результате химических реакций? Так как учащиеся изучали реакции соединения фосфора и магния с кислородом, и знают состав воздуха, то учитель может этот вопрос повторить и более определенно: изменяется ли масса атомов фосфора (или магния) и кислорода при горении фосфора на воздухе? Чтобы получить ответ на этот вопрос, предлагает учащимся наблюдать опыт, который он будет демонстрировать. Показывая прибор, описывает, как будет происходить опыт: помещает в ложечку фосфор или магний так, чтобы горючее соприкасалось с нихромовой спиралькой, прикрепленной к ручке ложечки и металлическому стержню, закрывает плотно склянку и уравновешивает ее на технохимических весах. Желательно заранее, подобрать разновес, чтобы процесс уравновешивания занял немного времени.
Для демонстрации процесса горения внутри склянки следует прибор снять с чашки весов, поставить его на подъемный столик, присоединить к ручке железной ложечки и к металлическому стержню электропровода и включить прибор в осветительную сеть последовательно с электроплиткой. При этом нужно придерживать резиновую пробку, чтобы давлением нагретых газов не выбросило ее из склянки. После охлаждения прибора учитель снова взвешивает его, учащиеся убеждаются в том, что вес прибора не изменился. Затем опыт анализируется, и учащиеся приходят к выводу, что вес кислорода и фосфора, соединявшихся между собой, равен весу получившегося окисла фосфора (или магния). Так как массы веществ пропорциональны их весу, то значит, что массы атомов фосфора и кислорода не изменились в процессе их соединения молекулы окисла фосфора. После демонстрации опытов уместно поставить вопрос: можно ли на основании их сделать вывод, что при всех химических явлениях масса веществ, вступивших в реакцию, равна массе веществ, полученных после реакции? Отвечая на этот вопрос, учитель должен разъяснить, что в химии и других науках приято делать обобщения на основании не одного, а многих опытов. Поэтому нужно ознакомиться с тем, какие опыты были пройдены выдающимися учеными, открывшими и проверявшими открытие этого закона. В краткой беседе на эту тему следует обратить внимание на то, что М. В. Ломоносов первый проверил опытным путем философский постулат о неуничтожаемости мафии, сформулировал его как закон природы и применил в научных исследованиях. Поэтому этот закон следует называть законом М. В. Ломоносова. Важно отметить, что он не случайно открыл этот закон: М. В. Ломоносов предвидел его на основе корпускулярной теории, которой он руководствовался в своих научных работах по химии. Так как учащиеся уже ознакомились с атомно-молекулярной теорией, то они поймут, каким образом эта теория помогла открыть основной закон химии.
Следует напомнить, что, согласно атомной теории, атомы" при химических реакциях не дробятся и не составляются из каких-либо более мелких частиц. В веществах, получаемых в результате реакции, содержатся те же атомы, которые были в исходных веществах. Общая масса всех атомов при химических реакциях не изменяется. Следовательно, общая масса веществ, вступивших в реакцию, равна массе веществ, полученных после реакции. Этот теоретический вывод М. В. Ломоносов проверил точно поставленными химическими опытами в академической лаборатории. Можно кратко рассказать об этих опытах и затем: процитировать формулировку закона сохранения массы веществ, данную М. В. Ломоносовым, сообщить, как формулируется этот закон в современных: учебниках химии для средней школы.
Для характеристики метода научно-исследовательской работы М. В. Ломоносова уместно отметить, что он придавал большое значение количественным определениям и первый принял за правило производить анализ "по мере и весу", значительно раньше французского ученого А. Лавуазье. Следует также отметить, что М. В. Ломоносов придавал большое значение открытому им закону, так как он стремился превратить химию в точную науку, или, как он выражался, в "математическую химию".
После этого можно напомнить об опытах А. Лавуазье, проделанных им для изучения состава воздуха и выяснения процесса окисления металлов. При этом следует сказать, что во времена М. В. Ломоносова весами пользовались только немногие ученые, в том числе и он, а во времена работ А. Лавуазье весы уже вошли в практику исследований по физике и химии. В своих научных исследованиях А. Лавуазье, применяя весы, основывался на законе сохранения массы веществ, но специальных опытов для доказательства этого закона не производил: по-видимому он считал его само собой понятным. Затем следует сообщить об экспериментальных работах, проведенных специально для проверки закона сохранения массы веществ выдающимися учеными в конце прошлого столетия и в начале нашего века.
Таким путем учащиеся должны прийти к выводу, что закон М. В. Ломоносова проверен и доказан самыми точными исследованиями. Вместе с тем они должны понять, что открытие этого закона и проверка его основаны на химических опытах, результаты которых зависят от лабораторной техники. Кроме того, следует сообщить, что для проверки закона изучались такие явления, в результате которых разлагаются и образуются молекулы, атомы же не дробятся. Поэтому не исключена возможность открытия более точных способов определения массы веществ, которые позволят обнаружить отступления от этого закона. После формулирования закона следует добавить оговорку: "при современном способе определения массы веществ". Вместе с тем нужно поставить такой вопрос: утратит ли значение этот закон в том случае, если при усовершенствовании техники взвешивания (или какого-либо иного способа определения массы) будут обнаружены какие-либо отступления?
Ответ должен быть следующим: значение закона сохранится; если и будут замечены отступления, они не могут быть значительными, судя по тому, что в настоящее время для практических целей масса определяется достаточно точно с помощью весов.
У учителя химии могут возникнуть вопросы: не слишком ли трудно для учащихся такое изучение основного химического закона, весьма простого и само собой понятного? Не проще ли дать учащимся VII класса понятие о законе, игнорируя пока задачу воспитания диалектического мышления и мировоззрения, оставив решение ее до X класса? Это, конечно, проще. Но не всякое упрощение может быть оправдано педагогически. В данном случае было бы неправильно вести изучение закона на метафизической основе только потому, что так проще. Учитель обязан излагать не только просто, но и правильно с точки зрения науки. Задача методики - указать способы доступного изложения сложного содержания.
Затем надо разобрать несколько примеров, на первый взгляд противоречащих закону: горение дров, ржавление и т. п. Можно показать опыты горения свечи: для этого нужно уравновесить ее на технохимических или аптекарских весах, зажечь, наблюдать уменьшение веса и дать объяснение опыта. Следует продолжить этот опыт и поглощать продукты горения натронной известью (рис. 27). В этом случае обнаружится увеличение общего веса горящей свечи и продуктов ее горения. С той же целью можно показать опыт окисления железных опилок, уравновешенных на весах. Зная состав воздуха и свойства, кислорода, учащиеся должны дать правильное объяснение и этому кажущемуся отклонению от закона сохранения массы веществ.
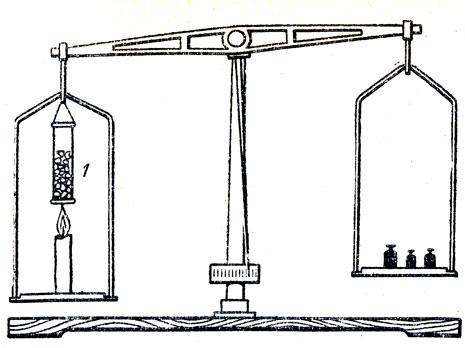
Рис. 27. Горение свечи на весах с поглощением продуктов горения
Можно привести два-три примера вычисления количеств веществ, которые должны получиться в результате реакции, если известно количество исходных веществ, или, наоборот, вычислить, какие весовые количества исходных веществ должны прореагировать, чтобы получилось заданное количество продукта реакции.
После ознакомления с атомно-молекулярной теорией и изучения закона сохранения масс, открытого М. В. Ломоносовым, уместно сообщить учащимся краткие сведения о жизни и деятельности этого великого сына русского народа, ученого и поэта. Так как М. В. Ломоносов оставил много трудов в различных областях науки и искусства, то и с биографией, и научными трудами его учащиеся знакомятся не только на уроках химии. Чтобы не было ненужных повторений, учителю химии необходимо согласовать содержание беседы о М. В. Ломоносове с учителями других учебных предметов: физики, географии, русского языка и литературы.
Значение закона сохранения массы
Научное и практическое значение закона сохранения массы веществ учащиеся могут оценить достаточно полно лишь после того, как они изучают большую часть вводного курса химии и ознакомятся с составлением химических уравнений и с расчетами по уравнениям. Теперь же достаточно ограничиться несколькими примерами применения этого закона. Можно рассказать об историческом опыте, проделанном А. Лавуазье для доказательства того, что вода при кипячении не превращается в "землю", как думали некоторые из ученых того времени. А. Лавуазье кипятил в течение 100 дней дистиллированную воду, которую он перед опытом взвесил в стеклянном сосуде (тоже взвешенном перед опытом). При кипячении воды водяные пары поднимались, охлаждались, и образовавшаяся жидкая вода стекала обратно в нижнюю часть сосуда. По истечении 100 дней А. Лавуазье обнаружил на дне сосуда значительное количество твердого осадка. После охлаждения сосуда он отделил воду от осадка и взвесил отдельно воду, осадок и сосуд. Оказалось, что вес воды остался тем же, а вес сосуда уменьшился на столько, сколько весил осадок. Отсюда следовал вывод, что осадок получается не из воды, а из стекла сосуда. Можно указать на значение закона сохранения массы веществ для опровержения религиозных учений о сотворении мира, о чудесах. В связи с этим надо сообщить, что М. В. Ломоносову приходилось вести борьбу не только с иностранным засильем, но и с религиозным мракобесием. Церковники видели в М. В. Ломоносове как натуралисте опасного врага церкви, подрывающего своими научными работами религиозные устои.
При всех условиях необходимо отметить, что М. В. Ломоносов был широкообразованным человеком того времени, усвоившим в основном материалистические взгляды на мир. Достигнув вершин научных знаний своего времени, обладая большим умом, смелостью и твердым характером, он не раболепствовал перед учеными Запада, а разумно пользовался достижениями науки, отметая предрассудки и все то, что противоречило его материалистическому мировоззрению и не оправдывалось опытной проверкой. Будучи знаком с атомистическим учением древних философов, выдающихся мыслителей эпохи Возрождения и нового времени, он не просто усвоил взгляды своих предшественников и современников, но творчески переработал научное наследство и создал более, полное учение о строении вещества, опередив в этом отношении европейских ученых на десятки лет. Особенно важно сообщить, что М. В. Ломоносов с успехом применил атомно-молекулярное учение к объяснению ряда, физических и химических явлений (учение о теплоте, окисление металлов при прокаливании их на воздухе).
Для характеристики научной деятельности М. В. Ломоносова, методов его работы следует рассказать о том, что он подтверждал свои теоретические исследования экспериментальными работами, применяя взвешивание веществ. Ему принадлежит честь и заслуга в организации первой научной лаборатории по химии в России. За границей считают, что первую учебную лабораторию и первые практические занятия по химии со студентами организовал немецкий ученый Либих. Это неверно. Либих жил и работал значительно позже М. В. Ломоносова, который в своей лаборатории вел научные работы и обучал студентов. Необходимо также указать, что М. В. Ломоносов связывал науку с жизнью, стремился к тому, чтобы поставить науку на службу своей родине. Он составил руководство по горному делу и металлургии, работал по стеклоделию. Для характеристики М. В. Ломоносова как ученого-патриота необходимо рассказать о той борьбе, которую он вел в Российской академии наук, о том, что он старался привлекать к науке талантливых русских людей, развивать и распространять науки в России. Благодаря его стараниям в 1775 г. был открыт Московский университет, который называется теперь Московский ордена Ленина государственный университет имени М. В. Ломоносова. В порядке дополнительной внеклассной работы можно предложить учащимся более подробно ознакомиться с биографией М. В; Ломоносова и сделать соответствующие сообщения на занятиях химического кружка. Желательно отвести в химической лаборатории место и поставить стенд для размещения ученических работ, газетных вырезок и другого материала, связанного с изучением жизни и деятельности М. В. Ломоносова.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'