
Кислород
Учебные задачи и содержание темы. Еще до начала изучения химии учащиеся приобретают некоторые сведения о кислороде из обыденной жизни, на уроках природоведения и ботаники (в IV-V классах). Поэтому одна из задач обучения по этой подтеме состоит в приведении разрозненных знаний учащихся об этом элементе в определенную систему на основе атомно-молекулярного учения. Вторая задача - обогащение учащихся знаниями о свойствах кислорода, о его распространении в природе, применении в различных областях народного хозяйства и получении в лаборатории. В процессе изучения кислорода продолжается формирование у учащихся основных химических понятий - о веществе, о химической реакции, об атоме и молекуле - и вводятся новые понятия - окисление, окислы. Создание необходимых условий для формирования этих понятий составляет третью задачу обучения по этой подтеме. Развитие у учащихся умений самостоятельно выполнять химические опыты и пользоваться учебником для приобретения знаний также входит в число учебно-воспитательных задач в преподавании и по данной подтеме. В результате изучения кислорода учащиеся должны приобрести следующие знания:
1. Химический знак кислорода, молекулярная формула, атомная масса и молекулярная масса.
2. При обыкновенных условиях кислород - газ в 16 раз тяжелее водорода, без цвета и запаха, в одном литре воды растворяется при обыкновенной температуре 30 мл кислорода, жидкий кислород кипит при 183°С.
3. Кислород может непосредственно соединяться со многими химическими элементами. В результате этих реакций получаются вещества, называемые окислами. Реакция присоединения кислорода к какому-либо веществу называется окислением. Большинство окислительных реакций сопровождается выделением энергии. Реакции, протекающие с разогреванием продуктов реакций, называются экзотермическими. Кислород в природе находится в свободном состоянии, в смеси с другими газами, растворен в воде и входит в состав множества сложных неорганических и органических веществ.
4. Благодаря химический активности кислород применяется для получения многих веществ, а вследствие экзотермичности окисления он используется для получения высокой температуры пламени при выплавке или при сварке металлов.
5. В лаборатории кислород получают для учебных целей разложением некоторых веществ, содержащих кислород и разлагающихся при прокаливании.
В процессе изучения кислорода учащиеся должны приобрести умения по технике эксперимента: закреплять пробирку в лапке штатива, а муфту на стержне штатива, нагревать пробирку с сухим веществом и собирать газ вытеснением воды или воздуха.
При изучении кислорода учащиеся знакомятся с тем, как человек, познавая природу, использует эти знания для улучшения условий своей жизни. Выявление связи науки с жизнью также является одной из учебных задач преподавания по теме "Кислород".
Так как кислород изучается первым из химических элементов во вводном курсе химии, то важно установить план его изучения и в дальнейшем придерживаться установленной последовательности при изучении и других элементов. Это облегчает учащимся усвоение знаний отдельных фактов и понятий, а также связи между ними.
При выборе плана изложения темы необходимо обеспечить наиболее полное использование учащимися уже полученных ими знаний для восприятия вновь изучаемого. Желательно организовать процесс обучения так, чтобы учащиеся до некоторой степени могли предвидеть изучаемое на основе имеющихся у них знаний.
Из всего того, что учащиеся должны угнать о кислороде, наиболее важным является знание свойств его в свободном состоянии. Исходя из этого, учащиеся могут легче осознать и даже предвидеть распространение кислорода в природе, уяснить роль его в процессах, происходящих в природе. Зная химические свойства кислорода, учащиеся воспримут как логическое следствие из этого состав его важнейших соединений, нахождение в природе, способы получения и применение. Таким образом, весь комплекс знаний о кислороде может быть логически связан в единое целое, а не представлять конгломерат разрозненных сведений, получаемых в произвольном порядке. На основании изложенного можно предложить следующий план изучения темы: 1) свойства кислорода; 2) нахождение в природе; 3) применение; 4) получение.
Физические свойства кислорода
Изучение кислорода следует начинать с. рассмотрения простого вещества, его физических свойств. Кислород должен быть заготовлен заранее, до начала урока, и храниться в колбах, склянках, а еще лучше в стеклянном газометре. Если в школе нет газометра, то можно приготовить самодельный газометр. На рисунке 28 изображен такой газометр, который с успехом заменяет фабричный и даже имеет некоторые преимущества, а именно при наполнении его кислородом или каким-либо другим газом, малорастворимым в воде, не нужно выпускать воду из газометра в раковину или в ведро, как это делается при наполнении фабричных газометров, а достаточно переставить склянки, как указано на рисунке, и собрать кислород в верхнюю склянку. Чтобы взять кислород из такого газометра, нужно переставить склянки, как указано на рисунке. Таким образом, можно все время пользоваться газометром, обходясь одним и тем же количеством воды. За неимением тубулатных склянок можно воспользоваться простыми склянками и даже бутылками (рис. 29).
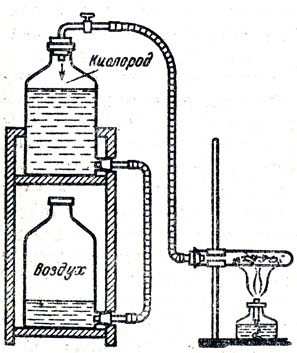
Рис. 28. Самодельный газометр, состоящий из двух тубулатных склянок
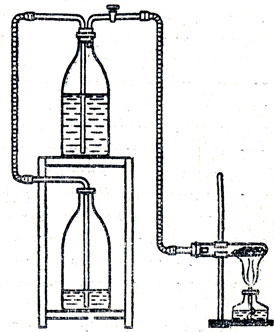
Рис. 29. Самодельный газометр, состоящий из двух бутылей
То обстоятельство, что учащиеся владеют некоторыми знаниями о свойствах кислорода, обязывает учителя правильно использовать эти знания для усиления познавательной активности на уроках, отведенных изучению кислорода.
Два существенных изменения должны быть внесены в метод беседы, который применяется обычно на уроках на данную тему. Во-первых, должно быть предоставлено время для выяснения того, что учащиеся знают о кислороде. Искусство руководства таким "обменом жизненным опытом" состоит в том, чтобы задерживать внимание учащихся на тех сообщениях, которые соответствуют цели урока, и проходить быстро мимо сведений второстепенных, уводящих беседу в сторону от ее цели.
Вторая особенность проведения беседы - решение целесообразно подобранных химических задач, текстовых и экспериментальных. Эти задачи должны вытекать из сообщений учащихся о свойствах кислорода как упражнение в применении знаний, в процессе которого учащиеся приобретают дополнительные сведения о кислороде. Рассказывая о физических свойствах кислорода, учащиеся обычно сообщают, что кислород - газ, и не указывают условия его газообразного состояния. Учитель сам рассказывает об этом, но учащиеся воспринимают его рассказ пассивно. Такие знания недолговечны, а самое главное, их приобретение не развивает у учащихся стремления к познанию. Иное отношение к учению возникает, если учитель признает этот ответ неточным и предложит учащимся указать эти неточности. Если учащиеся ничего не знают о жидком кислороде, тогда учитель сообщает о трех состояниях кислорода при разных температурах. Теперь это сообщение воспринимается иначе: как ответ на вопрос, который они пытались решить сами.
При ознакомлении учащихся с плотностью кислорода они должны узнать, что кислород немного тяжелее воздуха. Эти знания они могут получить со слов учителя или же на основе наблюдения демонстрируемого опыта. Демонстрацию можно провести, применяя вторую или четвертую форму сочетания слова учителя со средствами наглядности. В случае применения второй формы учитель начинает беседу с постановки вопроса: какой газ тяжелее - воздух или кислород? Учащиеся отвечают, что нужно взвесить тот и другой газ. Тогда следует второй вопрос: как это сделать, не взвешивая ни кислород, ни воздух? Надо навести учащихся на мысль о том, как собирать в цилиндр газы, которые легче или тяжелее воздуха. После этого учитель наполняет кислородом два одинаковых цилиндра, один из которых при наполнений держит вверх дном. Затем, не закрывая цилиндров, он оставляет один из них стоять на столе, а другой держит перевернутым вверх дном в течение 10-15 сек. После этого вносит тлеющую лучинку в оба цилиндра, она вспыхивает в обоих. Это значит, что ив том и в другом цилиндре находится кислород. Но можно заметить, что в перевернутом вверх дном цилиндре лучинка горит не так ярко, как в другом, Значит, концентрация кислорода там меньше. Из этих наблюдений должны быть сделаны следующие выводы: кислород немного тяжелее воздуха. Учителю остается уточнить эти сведения: сообщить вес литра чистого кислорода и вес литра воздуха.
Изучение растворимости кислорода в воде тоже можно начать с вопроса: растворяется ли кислород в воде? Некоторые учащиеся отвечают утвердительно и приводят в доказательство то, что рыбы дышат, пропуская воду через жабры. Других же доказательств растворимости кислорода они не знают. Чтобы показать сравнительно малую растворимость этого газа, рекомендуется показать опыт (рис. 30). В большую (литровую) колбу наливают до половины прокипяченную холодную воду, зачтем осторожно, не встряхивая колбы, наполняют ее кислородом, плотно закрывают резиновой пробкой, через которую проходит изогнутая стеклянная трубка. Свободный конец этой трубки опускают в стакан с подкрашенной жидкостью и взбалтывают воду в колбе. По поднятию подкрашенной жидкости в стеклянной трубке можно судить об уменьшении объема кислорода в колбе вследствие его растворения в воде.
Педагогический эффект получается различный в зависимости от метода демонстрации этого опыта. Учащиеся без особого напряжения внимания смотрят, когда учитель демонстрирует опыт после сообщения его результата, т. е. применяет третью форму сочетания слова с показом средств наглядности. Внимание учащихся и мыслительная деятельность усиливаются, когда применяется первая или вторая форма сочетания слова и показа опыта. Например, учитель вместе с учащимися решает задачу: как узнать, растворяется ли кислород в воде, если растворяется, то много или мало его переходит в раствор. Затем он предлагает воспользоваться прибором, изображенным на рисунке 30, и разрабатывает вместе с классом методику выполнения опыта: сколько и какой воды налить в колбу, как наполнять ее кислородом, как изменится давление в колбе, если кислород растворится, как узнать об уменьшении давления, какую жидкость налить в стакан и что дальше делать и как наблюдать.
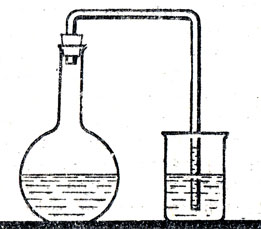
Рис. 30. Прибор для обнаружения растворимости кислорода в воде
Разумеется, не все учащиеся одинаково активно участвуют в этом "исследовании", но те, кто только слушает и наблюдает, узнают не меньше того, если бы они наблюдали демонстрацию. Чтобы у учащихся создалось более яркое представление о соотношении объемов растворенного кислорода и воды, можно показать поставленные на подъемный столик двухлитровую склянку с водой и маленькую скляночку емкостью 60 мл.
После этого учитель предлагает учащимся изложить кратко, что они узнали о физических свойствах кислорода. Не будет лишним, если они после ответа прочитают в учебнике о физических свойствах кислорода и проверят правильность и полноту своего ответа.
Химические свойства кислорода
Тот же метод ведения беседы можно применять и при изучении химических свойств кислорода. Сначала проверяют и уточняют знания учащихся - какие свойства называются химическими. Затем выясняют, что кислород как простое вещество может участвовать только в двух типах реакций (соединения и замещения), после чего ставятся задачи изучения реакций соединения кислорода с другими простыми веществами, известными учащимся (с серой и железом).
Вместо того чтобы рассказывать, как происходит реакция соединения серы и кислорода, учитель предлагает следующий вопрос: соединяется ли кислород с серой? Так как учащиеся уже наблюдали горение серы при изучении реакции соединения серы с железом, то большинство отвечают на этот вопрос утвердительно, но не указывают, при каких условиях начинается эта реакция. Учитель предлагает проверить этот ответ опытом. Он наполняет стеклянную банку кислородом, затем берет железной ложечкой небольшое количество измельченной серы и опускает в банку с кислородом. Сера не горит. Учитель смотрит испытующе на учащихся. В классе скоро наступает оживление, так как всегда находятся учащиеся, которые догадываются о причине отрицательного результата опыта и предлагают сначала поджечь серу и потом опускать в банку с кислородом. Учитель повторяет опыт с тем, однако, изменением, что вносит в кислород уже горящую серу. Затем он предлагает учащимся объяснить, почему серу поджигали только для начала реакции, а потом она продолжала гореть. Такой вопрос оказывается неожиданным, а ответ на него трудным - учитель сам отвечает. Обычно после объяснение учащиеся так резюмируют объяснение учителя: "реакция сама себя подогревает". Учитель же, пользуясь данным случаем, обращает внимание учащихся на необходимость выяснения условий, при которых проходят химические реакции. Особенно важно учитывать температуру. Можно предложить привести из обыденной жизни пример химической реакции, которая начинается только при высокой температуре, а затем продолжается без внешнего подогрева. На основании разбора этой реакции учащиеся записывают химическими формулами схему реакции (или уравнение).
В дополнение к этому опыту рекомендуется показать горение железа по следующим методическим соображениям: 1) горение в кислороде вещества подчеркивает химическую активность кислорода и необходимость предварительного нагревания (применение "запала"); 2) о высокой температуре в зоне горения железа можно судить по яркости искр и плавлению окалины; 3) продукт реакции, окисел, - твердое вещество, его легко рассмотреть и сравнить с природным магнитным железняком. Можно показать сжигание стального пера в стеклянной банке емкостью около литра (в сосуде малой емкости опыт не всегда удается, так как почти весь кислород расходуется на горение "запала"). Для успешного выполнения этого опыта рекомендуется (путем сухой перегонки соответствующих размеров лучинок) приготовить уголек длиной около 2 см, диаметром около 0,3 см, расщепить стальное перо и вставить в образовавшийся зазор уголек (рис. 31); затем накалить уголек в пламени горелки, нагревая одновременно и стальное перо, и внести раскаленный уголек в банку с чистым кислородом, медленно опуская его круговыми движениями ко дну банки.

Рис. 31. Стальное перо с укрепленным в нем 'запалом'
Если же опустить горящий уголек сразу на дно сосуда с кислородом, то получающийся при горении угля углекислый газ вытеснит кислород из средней и верхней части сосуда, и горение прекратится. При слишком медленном опускании интенсивность горения может оказаться недостаточной для того, чтобы перо накалилось до температуры, необходимой для начала горения железа. Анализ этого опыта проводится в том же плане, что и анализ предыдущего опыта.
Можно показать горение железа таким способом: намазать клейстером узкую полоску бумаги, обсыпать ее порошком восстановленного железа и высушить. Перед внесением в банку с кислородом конец этой бумажной полоски нужно поджечь.
Вопрос о методике демонстрации этих опытов решается исходя из учебных задач, с учетом состояния знаний учащихся и сложности демонстрируемых опытов. Если учитель имеет в виду не только сообщение знаний, но и развитие наблюдательности и мышления у учащихся, то он может применить исследовательский метод в том варианте, который применялся при демонстрации горения серы. На примере двух экзотермических реакций учитель сможет показать химическую активность кислорода в отношении к простым веществам. Некоторые опытные учителя химии включают в описанный урок не только демонстрации предметов и процессов, но и работу учащихся с раздаточным материалом, и простейшие ученические опыты. Учащимся раздают пробирки, наполненные кислородом и опущенные открытыми концами в пневматические ванночки. В процессе беседы учащиеся наблюдают физическое состояние, цвет кислорода, определяют, что это газ без запаха; затем сжигают в пробирках с кислородом угольки и сравнивают плотность воздуха и кислорода (держат открытыми пробирки с кислородом - одну вверх донышком, а другую вниз - и испытывают находящийся в них газ тлеющей лучинкой). Такое обучение проходит при повышенном интересе учащихся, что положительно сказывается на качестве знаний и умений, приобретенных учащимися на уроке. После этого необходимо сделать выводы:
1. Кислород может соединяться не только с железом и серой, но и с другими химическими элементами.
2. В большинстве случаев эти реакции сопровождаются выделением большого количества теплоты.
3. В результате соединения кислорода с другими элементами получаются окислы.
Реакцию замещения кислородом другого элемента не представляется возможным изучать на данной ступени обучения химии. В заключение химической характеристики кислорода следует указать на то, что кислород может присоединяться не только к простому, но и к сложному веществу, что эти реакции могут проходить не только быстро (как горение), но и медленно. Здесь же уместно ввести термин "окисление" и формулировать определение окислов.
Окисление. Окислы
Примером медленного окисления сложных веществ может служить процесс дыхания, который рассматривается на уроках биологии. Обращение к тому, что изучено на уроках по другому предмету, и в частности к биологии, имеет большое образовательное значение, так как способствует формированию правильного взгляда на химию как одну из наук о природе.
При этом следует отметить энергетическую сторону этих реакций, что за счет энергии окисления осуществляются многие жизненно важные процессы, связанные с затратой энергии.
Обращая внимание учащихся на экзотермичность многих окислительных реакций, следует предупредить образование ошибочного обобщения, состоящего в том, что учащиеся считают все реакции соединения элементов с кислородом экзотермическими. Нужно сообщить, что существуют и эндотермические окислительные реакции, например соединение азота с кисло родом.
В связи с изучением кислорода формируется понятие "окисел": учащиеся наблюдают образование окислов при горении простых веществ. На этом основании они часто определяют окисел как соединение элемента с кислородом. В этом определении нет ошибки, но если этим определением ограничиться, то учащиеся распространяют его на продукты окисления и сложных веществ. Поэтому к определению окисла нужно подводить учащихся на основе сравнения состава нескольких окислов. Для этого можно организовать самостоятельную работу по плану, указанному в работе № 8, стр. 99 учебника (изд. 1969 г.). Но нужно добавить требование к учащимся: на основании сравнения состава окислов указать, что общего у всех окислов, и написать, какие вещества называются окислами.
Распространение в природе и применение кислорода. Приобретенные учащимися знания о химических свойствах кислорода позволяют установить причинно-следственные связи между этими свойствами, нахождением этого элемента в природе и применением в различных областях народного хозяйства. Так как необходимые сведения, предусмотренные программой по этой теме, даны в учебнике, то представляется возможным организовать самостоятельную работу учащихся с учебником на уроке по заданию учителя. Во вводном слове учитель указывает на необходимость связывать описанные в учебнике сведения о нахождении кислорода в природе, о его роли в жизни животных, человека и о применении со свойствами кислорода.
Чтобы закрепить эти связи в сознании учащихся, можно организовать их самостоятельную работу с учебником на уроке. Пользуясь учебником, они должны кратко ответить (желательно письменно) на вопросы о нахождении кислорода в природе: в каком виде (в смеси, или в растворе, или в соединении с другими элементами) находится кислород в природе: в атмосфере, в воде (в гидросфере), в земной коре, в живой природе? Какое участие он принимает в важнейших химических процессах, происходящих в живой и неживой природе?
О применении кислорода: укажите важнейшие области народного хозяйства, где применяется кислород (учебник, § 23). На каком свойстве кислорода Основано это применение?
После выполнения задания учитель проводит заключительную беседу со всем классом. В $той беседе зачитывается выборочно два-три отчета и вносятся исправления. Кроме того, учитель сообщает дополнительные сведения, не вошедшие еще в учебник, но имеющие большое научное или практическое значение.
Получение кислорода. Так как учащиеся уже приобрели предусмотренные программой знания о свойствах кислорода, то ученические экспериментальные работы на эту тему имеют целью уточнение и закрепление этих знаний и развитие умений, относящихся к технике химического эксперимента, а также умений самостоятельно, пользуясь знаниями учителя, выполнять сравнительно сложные опыты получения, собирания кислорода и испытание его свойств.
В качестве исходного материала для получения кислорода можно рекомендовать марганцовокислый калий, так как разложение его идет спокойно и реакция эта вполне безопасна. Можно получить кислород и из бертолетовой соли. В этом случае необходимо соблюдать осторожность и быть особенно внимательным при наблюдении за выполнением этого опыта учащимися: примеси угля и других органических веществ к бертолетовой соли могут послужить причиной взрыва при ее нагревании. Кроме того, применение бертолетовой соли для получения кислорода обязывает учителя знакомить учащихся с явлением катализа и с двуокисью марганца как катализатором.
Собирать кислород можно путем вытеснения воздуха или воды из сосуда. Первый способ проще. Опыт проходит гладко, но учащиеся затрудняются определить, когда сосуд наполнен кислородом. При испытании тлеющей лучинкой они опускают ее на дно банки так часто, что кислород расходуется на горение этой лучинки и учащиеся иногда не в состоянии набрать в банку столько кислорода, чтобы можно было проделать с ним необходимые опыты.
При собирании кислорода в банку, наполненную водой, учащиеся видят, сколько газа собирается, но для успешного выполнения опыта в такой постановке требуются некоторые экспериментальные навыки. Иногда учащиеся неправильно рассчитывают, сколько нужно влить воды в пневматическую ванну, и при вытеснении кислородом воды из банки в ванне оказывается избыток воды, которая выливается на стол. В некоторых случаях учащиеся временно прекращают нагревание пробирки с разлагаемой солью, не вынимая газоотводной трубки из воды. Вода перетягивается в пробирку с нагреваемым веществом. Такие неудачи постигают не только учащихся, начинающих работать по химии, но и учащихся старших классов. Поэтому для таких опытов лучше пользоваться прибором, изображенным на рисунке 32. Склянка является предохранителем: в случае прекращения нагревания пробирки с разлагаемым веществом вода перебрасывается в этот сосуд, а при продолжении опыта она перекачивается давлением газа опять в пневматическую ванну.
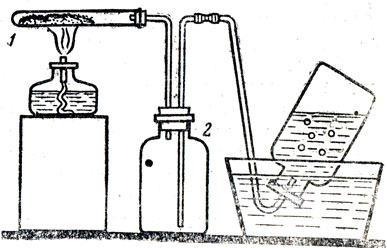
Рис. 32. Прибор для получения кислорода: 1 - пробирка с перманганатом калия, 2 - предохранительная склянка
В кислороде, собранном тем или иным способом в стеклянные банки, учащиеся могут сжечь уголь или стальное перо в зависимости от условий выполнения опыта. Нужно учесть, что для сжигания стального пера или железной проволоки нужно не менее полулитра чистого кислорода. Кроме того, нужно подробно рассказать и показать, как это делается.
В данной работе учащиеся приобретают следующие умения: 1) собирать прибор, в котором основные детали монтируются на железном штативе, 2) проверять герметичность прибора, 3) собирать малорастворимый газ над водой, 4) избегать переброса воды из сосуда с водой в пробирку, в которой нагревается твердое вещество (перманганат калия или бертолетова соль). Эта работа сходна с первым лабораторным занятием. Здесь учащиеся не приобретают новых для них знаний, а учатся применять полученные знания и овладевать техникой химического эксперимента. Но организация ее должна отличаться тем, что задание расчленяется на меньшее количество частей и каждая часть включает более сложные требования. В этой практической работе следует уделить особое внимание ознакомлению с прибором, чтобы учащиеся могли установить связь между конструкцией прибора и его назначением, между материалом, из которого он изготовлен, и теми процессами, которые в нем должны происходить.
В прилагаемой ниже работе три части. После выполнения каждой из них следует обсуждение ее выполнения.
Примерное задание для самостоятельной работы на тему "Получение кислорода и изучение его свойств". Подготовка прибора к опыту. Если для опыта использовать прибор, изображенный на рисунке 32, то надо сначала поставить горелку на подставку штатива, укрепить на штоке муфту и держатель, в котором закрепить пустую пробирку. После этого следует передвинуть муфту с держателем и с пробиркой так, чтобы нижняя часть ее находилась в средней части пламени горелки. Затем необходимо закрыть пробирку пробкой с газоотводной трубкой, а конец ее опустить в ванночку с водой и проверить герметичность прибора. Для этого нагреть пробирку, обхватив ее рукой, или слегка подогреть пламенем горелки и наблюдать выделение пузырьков воздуха из того конца трубочки, который погружен в воду. Воздух выходит из пробирки вследствие того, что его объем увеличивается при повышении температуры. Когда пробирка охладится, вода станет подниматься по трубке вверх. Если пробирку нагревали сильно и воздуха из пробирки вышло много, то при ее охлаждении вода может перейти из ванночки в пробирку. Чтобы не допустить этого, нужно открыть пробирку, как только вода поднимется высоко по трубке. Если прибор негерметичен (плохо подогнана пробка или слишком свободно входит в нее стеклянная трубка), то ни выхода воздуха из пробирки, ни подъема воды по трубке не происходит. После проверки и исправления прибора нужно наполнить водой банку, предназначенную для собирания кислорода, закрыть ее картонным кружочком, перевернуть вверх дном, погрузить в ванночку с водой и снять под водой кружочек.
Когда прибор будет подготовлен, следует показать его учителю и после его разрешения приступить к опыту.
Получение кислорода. Откройте пробирку, заполните около половины ее объема марганцовокислым калием и снова присоедините ее к прибору. Осторожно обогрейте всю пробирку пламенем горелки, чтобы удалить из нее воздух. Затем обогрейте только ту часть, где находится марганцовокислый калий. Как только усилится выделение газа, введите конец газоотводной трубки в стеклянную банку и наблюдайте наполнение ее газом. Вода в ванночке иногда окрашивается в фиолетовый цвет (часть, пылевидного марганцовокислого калия увлекается кислородом и растворяется в воде). Как только банка наполнится газом (вода опустится до ее горла), выньте газоотводную трубку из банки и из воды и только после этого прекращайте нагревание пробирки. Если же прекратить нагревание, а газоотводную трубку оставить в воде, то может произойти следующее: при охлаждении пробирки прекратится выделение кислорода, охладится оставшийся в пробирке газ и уменьшится его объем. Тогда вода поднимется по газоотводной трубке и войдет в пробирку. После того как газоотводная трубка будет вынута из ванночки, закройте банку под водой картонным кружочком, опрокиньте ее вниз дном и поставьте закрытую банку на стол.
Если будете пользоваться прибором, изображенным на рисунке 32, то можно прекращать нагревание пробирки, не вынимая газоотводной трубки. В этом случае при охлаждении пробирки вода тоже может подняться по газоотводной трубке, но перельется не в пробирку, а в предохранительную склянку. При возобновлении нагревания пробирки с марганцовокислым калием вода под давлением поступающего в склянку кислорода перейдет обратно из этой склянки в пневматическую ванну. Этот, прибор труднее изготовить, но пользоваться им значительно удобнее. Для этого прибора не требуется металлического штатива, его заменяет предохранительная склянка. Собранный газ покажите преподавателю.
Испытание полученного газа. Чтобы проверить, действительно ли полученный газ - кислород, осторожно откройте банку, внесите в ее верхнюю часть тлеющую лучинку, не погружая ее внутрь банки, чтобы не израсходовать много кислорода на эту пробу.
Поместите в железную ложечку небольшое количество серы, внесите ложечку в пламя горелки и держите до тех пор, пока она не загорится. Тогда внесите горящую серу в баночку с кислородом, наблюдайте за пламенем горящей серы, опускай постепенно ложечку ко дну банки. Отметьте различие в пламени серы, горящей в воздухе и в кислороде.
Напишите отчет, в котором укажите цель работы, нарисуйте прибор с указанием, где и какие вещества находились, нарисуйте опыт сжигания серы. Опишите кратко, как горит это вещество на воздухе и в кислороде. Затем прочитайте § 24 учебника и внесите в отчет исправления и дополнения, если в этом будет необходимость.
Приготовьте ответы на следующие вопросы:
1. Какие вещества называются катализаторами?
2. Назовите вещества, которые действуют как катализаторы в растениях и организмах животных?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'