
Горение
Учащимся должно быть известно значение открытия огня человеком, но немногие из них знают, каким трудным оказался путь овладения процессом горения. Во вводном курсе химии, до изучения углерода, не представляется возможным рассматривать более или менее основательно этот процесс.
В курсе химии VII класса необходимо сформировать первоначальное понятие о горении, которое освободило бы учащихся от неправильных представлении, образовавшихся при обучении в младших классах. К числу таких ошибочных суждений относятся следующие: 1) горение определяется как соединение горючего вещества с кислородом, 2) различают вещества, которые могут только гореть, но горения не поддерживать, и вещества, которые не горят, а только поддерживают горение, 3) дыхание, и гниение определяют как медленное горение.
Вместо этих ошибочных суждений учителю необходимо добиться усвоения учащимися следующих знаний о горении: горении - химическая реакция, сопровождающаяся сильным разогреванием и свечением продуктов реакции; горение на воздухе или в кислороде простых веществ состоит в соединении их с кислородом и в образовании окислов этих элементов; в процессе горения сложных веществ происходит разложение молекул горящего вещества и образования окислов тех элементов, из которых состоит горючее. Горение, как и всякая химическая реакция, происходит только при надлежащих условиях: при тесном соприкосновении молекул горючего с молекулами кислорода воздуха и в определенном температурном интервале. Эти сведения о горений учитель может сообщить, излагая кратко историю развития учения о горении. В соответствии с этим урок можно начать с разъяснения того, какую важную роль сыграл огонь в развитии человеческой культуры и какое значение имеет процесс горения в современной жизни человека. При этом важно отметить, что сущность процесса горения долго не была раскрыта вследствие того, что химия как наука сложилась позже других наук о природе.
Чтобы дать представление учащимся о том научном подвиге, который совершил М. В. Ломоносов, а затем А. Лавуазье, создавая учение о горении, можно кратко рассказать, в чем состояла ошибочная флогистонная теория горения, которая признавалась правильной в течение 100 лет. После этого следует сообщить, как понимал горение М. В. Ломоносов, опередивший в своих выводах западных ученых на полсотни лет. Нужно отметить смелость и независимость суждений этого гениального ученого, который в своих исследованиях руководствовался молекулярной теорией в отличие от многих своих современников и ученых даже более поздних поколений.
Не будет лишним, если учитель отметит, что А. Лавуазье, в противоположность М. В. Ломоносову, не придавал большого значения атомистической теории, вследствие чего не понимал сущности тепловых явлений и ошибочно допускал существование невесомого элемента теплорода. Излагая кислородную теорию горения, учитель сначала рассматривает горение в кислороде (и в воздухе) простых веществ и отмечает, что для данного случая подходит определение горения как соединения вещества с кислородом, а затем ставит вопрос: применимо ли такое определение к горению сложных веществ? Для ответа на этот вопрос можно показать опыт горения метана, или природного газа, или спирта и обнаружить в продуктах горения воду и углекислый газ (рис. 34). Не рассматривая подробно механизм этой реакции, необходимо отметить, что в данном случае не происходит присоединения атомов или молекул кислорода к молекулам метана, а получается окисел углерода и вода (окисел водорода).
Рис. 34. Прибор для обнаружения водяного пара и углекислого газа в продуктах горения метана, спирта или свечи
Условия возникновения и прекращения горения. Первоначальные сведения о горении учащиеся получили при изучении химических свойств кислорода. Тогда они узнали, что для начала горения необходимо довести горючее до надлежащей температуры. Теперь нужно распространить это условие и на горение других веществ и показать опыты прекращения горения, если снизить температуру в зоне горения. С этой целью следует показать горение скипидара в металлическом тигле или металлической коробочке (рис. 35). Сначала учитель показывает, что скипидар при обыкновенной температуре не загорается при поднесении к его поверхности пламени лучинки. Если же нагреть тигель со скипидаром, то горение начинается, но оно прекращается, если тигель с горящим скипидаром охлаждать, как указано на рисунке.
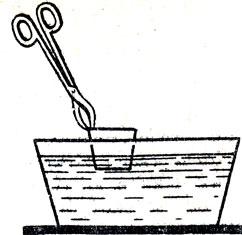
35. Прекращение горения скипидара
Чтобы показать необходимость доступа воздуха к горящему скипидару, нужно снова нагреть тигель со скипидаром, а затем, когда скипидар загорится, накрыть тигель металлической пластинкой. На основании наблюдений этих опытов учащиеся должны сделать следующие выводы: 1) чтобы горение скипидара началось, необходимо его подогреть до определенной температуры; 2) чтобы прекратилось горение скипидара, нужно сосуд с горящим скипидаром охладить; 3) горение скипидара может прекратиться и без охлаждения, если прекратить доступ воздуха к нему.
Состав и строение пламени. До изучения сухой перегонки органических веществ трудно понять, что такое пламя. Но и изучать горение, не упомянув о самом интересном, красивом в процессе горения, тоже невозможно, К тому же знание состава и строения пламени горелки (газовой или спиртовой) необходимо учащимся для сознательного пользования этими нагревательными приборами, Поэтому, идя сознательно на некоторые упрощения, следует все же ознакомить учеников со строением пламени.
Лучшим объектом для этого является пламя свечи. На основе наблюдений сложившегося опыта и специальных методических экспериментов можно рекомендовать следующий план изучения пламени:
1. Пламя - газообразное тело, меняющее свою форму.
2. В пламени свечи можно обнаружить три части, три конуса, входящих один в другой. Внутренний конус, темный, наименее горячий; его окружают наиболее светлый, горячий, и наружный, который имеет светло-оранжевый цвет.
3. Состав пламени. В наружном - углекислый газ и вода, в среднем - раскаленные частицы угля и горючие газы, во внутреннем конусе пары парафина.
4. Процесс горения парафиновой свечи.
5. Горение лучинки, спиртовки, газовой горелки.
Если учащимся предложить нарисовать пламя свечи на основе наблюдений демонстрации или рассматривания его вблизи, на ученическом столе, то, как показывает опыт, учащиеся не замечают никаких конусов. Форму пламени они замечают, если осветить пламя сбоку и наблюдать его тень на экране или на чистом листе бумаги. Лишь после этого учащиеся, наблюдая пламя свечи на близком расстоянии и слушая объяснения учителя, могут начертить схему строения пламени свечи. При дальнейшем изучении пламени следует воспользоваться рисунком его, помещенным в учебнике, или же схемой, нарисованной на классной доске.
Изучение состава пламени можно начать с внутреннего конуса. Сначала обращается внимание на расплавленный парафин и выясняется роль фитиля. Учащимся известно из курса ботаники, физики и из наблюдений окружающей жизни явление капиллярности. Поэтому они могут рассматривать роль фитиля как приспособления для подачи жидкого горючего в зону горения. Следовательно, около фитиля должны быть пары парафина. Так ли это? Для ответа на вопрос или демонстрируется опыт, или учащиеся проводят его сами, как изображено на рисунке 36. Чтобы разобраться в том, как происходит горение паров парафина, необходимо вспомнить горение метана: сначала происходит разложение его на углерод и водород, а затем каждый из этих элементов соединяется с кислородом.
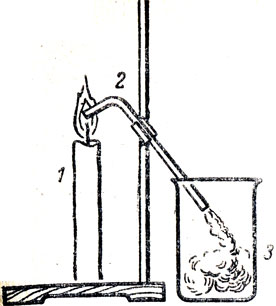
Рис. 36. Прибор для ознакомления с составом газа внутреннего конуса свечи: 1 - свеча, 2 - стеклянная трубка, 3 - стакан
Парафин состоит тоже из углерода и водорода, при нагревании он разлагается на углерод и горючие газы. Из углерода состоит сажа. Демонстрируется опыт и обнаруживается сажа в светлой части пламени. Возникает недоумение: как может находиться самое черное вещество в самой светлой части пламени? Учитель объясняет это тем, что светятся мелкие частицы раскаленного угля. Следовательно, эта часть пламени очень горячая. Остается узнать состав наружной части пламени. Для этого можно показать опыт, используя изображение прибора на рисунке 37. Чтобы лучше обнаружить водяные пары, можно поместить в расширенную часть пламени белый порошок прокаленного медного купороса: поглощая влагу, безводная сернокислая медь становится медным купоросом. Углекислый газ обнаруживается по помутнению известковой воды, через которую проходят газы.
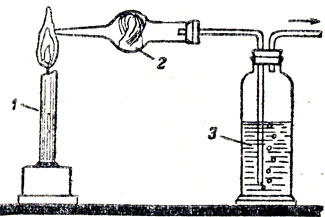
Рис. 37. Прибор для обнаружения углекислого газа и водяных паров во внешнем конусе свечи: 1 - свеча, 2 - шариковая трубка с марлей, смоченной раствором солей кобальта, 3 - промывная склянка с известковой водой
После изучения состава пламени нетрудно предвидеть, какая часть пламени самая горячая и какая имеет наименьшую температуру. Для проверки этих предположений можно показать хорошо известные опыты: внесение в пламя свечи спички или лучины - или предложить учащимся самим проделать их. После краткого повторения того, что узнали учащиеся о строении и составе пламени свечи, следует в качестве упражнений предложить им: внести в пламя спиртовой или газовой горелки лучину, объяснить, почему газовая горелка коптит при недостатке воздуха, поступающего в горелку. Можно также в качестве экспериментальных задач показать опыты с керосиновой лампой для выяснения процесса горения в ней керосина.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'