
Водород
Задачи и содержание обучения по подтеме "Водород". В процессе изучения водорода и его соединений учащиеся при рациональном обучении могут усовершенствовать и закрепить следующие знания: а) о простом и сложном веществе и химическом элементе; б) о реакциях соединения и замещения, об условиях начала и продолжения экзотермических реакций; в) о количественных соотношениях между элементами в их соединениях; г) о валентности; д) о химических свойствах кислорода.
В условиях активизации учебной деятельности учащихся представляется возможным развивать у учащихся умения самостоятельно выполнять безопасный опыт получения водорода и изучения его свойств: собирать простой прибор, собирать водород, испытывать его чистоту, оценивать прибор в отношении его пригодности для данного опыта и проектировать прибор по собственному замыслу.
Изучение водорода рекомендуется вести в том же порядке, который был принят при изучении кислорода: свойства, нахождение в природе, применение, получение.
Свойства водорода. Учитывая учебные задачи и содержание урока на эту тему, следует выделить в нем пять частей:
1. Подготовка учащихся к приобретению новых знаний;
2. Изучение физических свойств водорода;
3. Растворимость его в воде;
4. Химические свойства;
5. Заключение.
В качестве основного метода обучения на этом уроке рекомендуется эвристическая беседа. Как известно, повторение и приобретение новых знаний проходит более успешно, если проводить сравнение изученного и изучаемого. Изучение свойств водорода путем сравнения их со свойствами кислорода проходит более успешно: представления о водороде и кислороде при их сравнении получаются более яркими и удерживаются в памяти более прочно. Применение приема сравнения изученного с изучаемым в данном случае усиливает деятельность памяти и в то же время побуждает учащихся к приобретению знаний о новом элементе. Химический эксперимент, привлекаемый к изучению свойств водорода, слишком сложен для выполнения учащимися и представляет хорошее средство наглядности для демонстрации с целью не только лучшего восприятия учащимися, но и развития у них умений наблюдать, сравнивать, делать обобщения.
Эти аргументы (в пользу применения эвристической беседы на первом уроке) имеют силу только в том случае, если беседа будет действительно эвристической, а не совокупностью приемов "мышеловочной" индукции. Для этого необходимо стремиться к тому, чтобы число вопросов, предлагаемых учителем, было небольшим. Но каждый вопрос должен быть понятным учащимся и вызвать обстоятельный ответ учащихся.
На первый вопрос (зачем нужно изучать водород?) учитель отвечает сам и по возможности кратко, указав, что слово "водород" перешло из научной литературы в бытовую речь, и при этом осталось неясным, а иногда и ошибочным его понимание. Следующие вопросы могут быть сформулированы примерно так: в чем сходны и чем различаются свойства водорода и кислорода? Ответ состоит из двух частей: описание свойств кислорода дают учащиеся, а свойства водорода они узнают на основе наблюдений опытов, демонстрируемых учителем. Методы демонстрации зависят от готовности учащихся, от сложности опыта и задачи опыта. В данном случае представляется возможным отдать предпочтение первому и второму способу сочетания слова учителя со средствами наглядности, так как наблюдаемые явления доступны анализу учащихся.
Для ознакомления с физическими свойствами водорода учитель может, поставив на демонстрационный стол цилиндр, наполненный водородом, сказать, что это водород, и предложить учащимся перечислить его физические свойства. Они могут сказать только, что водород бесцветный газ, похожий на кислород. Подтвердив правильность этого ответа, учитель сообщает, что водород может быть и в жидком состоянии, и называет температуру кипения жидкого водорода. Не следует требовать от учащихся заучивания этой константы, а достаточно ограничиться указанием о необходимости запомнить, что водород кипит при температуре более низкой, чем кислород. Затем учитель ставит вопрос: что легче - воздух или водород? - и предлагает вспомнить, как решали они этот вопрос при изучении кислорода. После этого для сравнения веса одинаковых объемов воздуха и водорода демонстрирует опыт.
В учебной и методической литературе описано много простых и интересных опытов, которые могут быть использованы для ознакомления учащихся с тем, что водород легче воздуха. Наиболее наглядным (но не самым простым) следует признать опыт взвешивания на весах равных объемов воздуха и водорода. Более простым, но менее наглядным является переливание водорода из одного цилиндра в другой или наполнение водородом пробирок, перевернутых вверх дном. При ознакомлении учащихся с плотностью водорода достаточно показать один какой-либо из этих опытов. После получения правильного ответа, данного учащимися на основе наблюдений, учитель сообщает вес литра этого газа при нормальных условиях.
О плохой растворимости водорода в воде достаточно, сообщить учащимся, не прибегая к демонстрации опыта. Перед изучением химических свойств водорода учитель сообщает, что водород - простое вещество, и предлагает указать, какие, типы реакции должны быть свойственны водороду. Выбрав для начала изучения реакции соединения, учитель предлагает рассмотреть взаимодействие его с кислородом, который только что изучен. Учащимся предлагается рассказать о том, как они изучали химические свойства кислорода, как был показан опыт горения серы в кислороде. Учитель обращает внимание на условия течения этой реакции. После этого следует демонстрация опыта. Он смешивает в небольшом толстостенном стеклянном цилиндре (не более 150 мл) два объема водорода с одним объемом кислорода, обращает внимание учащихся на отсутствие каких-либо признаков реакции и. тем самым показывает, что при обыкновенной температуре эти вещества не соединяются друг с другом. Учащиеся обычно предлагают изменить условия опыта: повысить температуру смеси хотя бы в одном месте. Учитель открывает цилиндр и поджигает смесь ("гремучий газ") (цилиндр должен быть завернут в полотенце). Взрыв указывает на то, что реакция произошла. На основании этого опыта учащиеся делают вывод, что водород соединяется с кислородом при высокой температуре. Но в этом опыте нельзя обнаружить образование воды, так как при взрыве водяные пары выбрасываются из цилиндра, в котором если и останется вода, то только та, которая вытеснялась из цилиндра при наполнении его гремучим газом. Образование воды в результате соединения водорода с кислородом можно показать, пользуясь прибором, изображенным на рисунке 38.
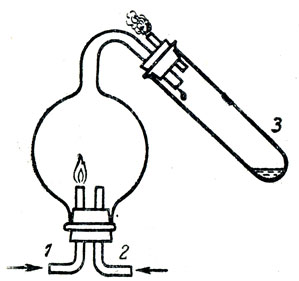
Рис. 38. Горенке водорода в кислороде: по трубке 1 поступает водород, по трубке 2 - кислород. На дне пробирки 3 - небольшое количество воды
Прибор должен быть небольшим - диаметр расширенной части трубки не больше 3 см. Опыт производится следующим образом: прибор укрепляют в штативе, затем вынимают пробку, через которую проходят две трубки, одну из них (керамическую) присоединяют при помощи резинового шланга к аппарату Киппа, в котором получается водород, а стеклянную трубку таким же образом присоединяют к газометру, в котором находится кислород. Сначала пропускают в трубку водород, поджигают его и устанавливают самое маленькое пламя, убавляя приток водорода; после этого пускают кислород из газометра по другой трубке и вставляют пробку с трубками так, чтобы пламя горящего водорода находилось в расширенной части приборчика. Через 3-4 мин в пробирке-приемнике появляется несколько капель синтезированной воды. Прекращают опыт так: сначала закрывают кран, подводящий водород, затем прекращают и приток кислорода. При демонстрации этого опыта важно обратить внимание учащихся на то, что конец керамической трубки, по которой поступает водород в прибор, накаляется добела, что свидетельствует об очень высокой температуре пламени. Это означает, что реакция соединения водорода с кислородом сопровождается выделением большого количества теплоты, что является признаком большой химической активности водорода в отношении к кислороду.
После того как учащиеся наблюдали горение водорода в чистом кислороде, они без труда дают правильные ответы на следующие вопросы: может ли гореть водород в воздухе? Какие вещества получаются в результате этой реакции?
Образование воды при горении водорода в воздухе учащиеся могут наблюдать, если на несколько секунд накрыть сухим холодным стаканом пламя горящего водорода. Водяные пары сгущаются на стенках стакана с внутренней стороны в виде мелких капель. Опыт проходит более эффектно, если держать над пламенем водорода утюг или сосуд с холодной водой. После одного из этих опытов можно рассмотреть реакцию соединения водорода с кислородом на основе атомно-молекулярной теории, а затем предложить учащимся рассказать все, что они узнали о свойствах водорода. Чтобы закрепить знания учащихся о составе воздуха и вместе с тем показать, что при горении водорода в воздухе водород соединяется только с кислородом, а азот остается свободным, можно показать следующий опыт. Водород, выходящий из стеклянной трубки, поджигают, затем эту трубку вводят в склянку, которую быстро погружают в воду (рис. 39), Как только пламя водорода в склянке погаснет, прекращают доступ в нее водорода и наблюдают повышение уровня воды в склянке. При этом вода занимает только 1/5 того объема, который был занят воздухом в склянке.
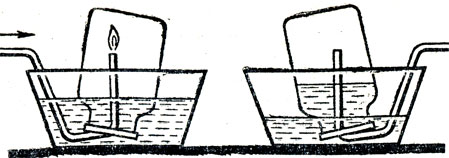
Рис. 39. Горение водорода в закрытой склянке
Демонстрацию этого опыта рекомендуется проводить с применением одного из вариантов исследовательского метода.
Получение водорода. После того как учащиеся ознакомились с важнейшим химическим свойством водорода - реакцией его с кислородом, наблюдали взрывы гремучего газа и водородо-воздушной смеси, они оказываются подготовленными к самостоятельной работе с малыми количествами этого газа.
Поэтому можно организовывать лабораторные занятия, на которых учащиеся должны получить небольшое количество водорода и проделать с ним опыты, безопасность которых должна быть гарантирована учителем (рис, 40). Опыты помогают закрепить знания и дополнить их изучением восстановительных свойств водорода на примере взаимодействия водорода с окисью какого-либо легко восстанавливающегося металла, например окиси меди, или окиси железа, или окиси свинца. В учебнике химии, которым пользуются учащиеся данного класса, описан опыт восстановления меди из окиси, а на лабораторных занятиях следует провести опыт восстановления железа из его окиси.
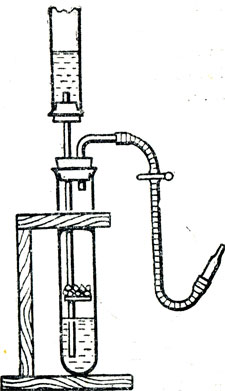
Рис. 40. Прибор автоматического действия для получения водорода на лабораторных занятиях
Для учащихся, проявляющих особый интерес к решению экспериментальных задач и имеющих некоторые умения проектировать приборы, описаний приборов не дается, а предлагается самим их придумать.
Ниже приводится один из вариантов заданий для лабораторных занятий учащихся.
Получение водорода в лаборатории и изучение его свойств
Цель работы.
1. Закрепление приобретенных учащимися знаний, и дополнительное изучение свойств водорода.
2. Приобретение первоначальных умений обращаться с горючими газами, образующими с воздухом взрывчатые смеси.
Выполнение работы.
Получение водорода. В широкой пробирке (рис. 41) находится соляная кислота. В эту пробирку вставляют узкую пробирку с пробитым донышком, на которое кладут мелкие обрезки или осколки стекла, а на них помещают зерна или обрезки цинка. Узкую пробирку плотно закрывают резиновой пробкой, через которую проходит стеклянная трубочка, закрытая резиновым колпачком.
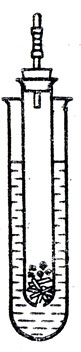
Рис. 41. Самодельный прибор для получения малых количеств водорода
Прибор нужно или поместить в деревянный штатив, или укрепить в железном штативе. Чтобы ознакомиться с действием прибора, снимите со стеклянной трубки колпачок не открывая пробки. Наблюдайте за тем, что происходит внутри узкой стеклянной трубки. Закройте снова стеклянную трубочку колпачком и опять наблюдайте. Объясните, почему при снятии колпачка кислота входит во внутреннюю пробирку, а при закрывании трубочки колпачком кислота выходит из этой пробирки в широкую пробирку.
Испытание чистоты водорода. Вам известно, что смесь водорода с воздухом взрывчата. Поэтому, прежде чем делать опыты с водородом, нужно убедиться в его чистоте. Для этого откройте газоотводную трубку, накройте ее чистой пробиркой и подержите в таком положении 5-10 сек. Затем осторожно снимите пробирку с трубочки и, не перевертывая пробирки, поднесите ее отверстием к пламени горелки. Если к водороду примешан воздух, то послышится свистяще-лающий звук. Если водород чист, послышится легкий хлопок.
Горение водорода в воздухе. После того как убедились в чистоте водорода, зажгите водород, выходящий из пробирки по трубке (рис. 41), обратите внимание на то, что пламя почти бесцветно. Накройте пламя водорода сухой стеклянной воронкой и наблюдайте появление "росы" на воронке. (Вместо воронки можно подержать над пламенем горящего водорода сухой стакан.) По окончании этого опыта закройте газоотводную трубку резиновым колпачком, чтобы прекратилась временно реакция и не расходовались без надобности цинк и кислота. Запишите уравнения реакций получения водорода действием кислоты на цинк, горения водорода. Объясните появление росы на холодном донышке стакана.
Взаимодействие водорода с окисью железа. Цель этого опыта - выяснить, соединится ли водород с тем кислородом, который находится в окиси железа. Для этого в изогнутую трубку (рис. 42) поместите небольшое количество окиси железа, ближе к изгибу, как изображено на классной доске. Нагревая трубку в том месте, где находится окись железа, наблюдайте за изменением цвета окиси железа и появлением водяных паров и капелек воды в трубке. Через 5 мин прекратите нагревание трубки и дайте охладиться содержимому трубки в токе водорода. После охлаждения отключите трубку от прибора, закройте ее колпачком, чтобы прекратить взаимодействие кислоты с цинком. Содержимое трубки высыпьте на чистый листик бумаги, испытайте его магнитом.
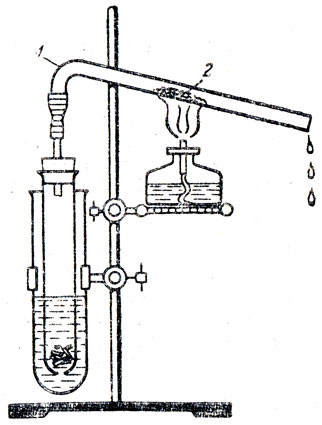
Рис. 42. Прибор для восстановления железа водородом: 1 - стеклянная трубка, 2 - восстановленное железо
Составление отчета. Перед составлением отчета прочитайте § 33 учебника. В отчете напишите уравнения реакций получения водорода и взаимодействия его с окисью железа, зарисуйте прибор. Запишите вывод из опыта.
В заключительной беседе после лабораторных занятий при анализе реакций соединения водорода с кислородом следует обратить внимание учащихся на то, что эти реакции характеризуют и водород и кислород. Можно сказать, что важнейшим свойством водорода является его соединение с кислородом, происходящее с выделением большого количества теплоты. В учебной и методической литературе рекомендуется формировать понятие об окислительно-восстановительной реакции как едином процессе на примере взаимодействия водорода с окислами металлов. Эта задача нетрудная, но делать обобщения о единстве окислительно-восстановительного процесса на основе только данной реакции преждевременно, так как это приводит к таким затруднениям, которые нельзя преодолеть при изучении химии на основе только атомно-молекулярной теории. В самом деле, если соединяется водород со свободным кислородом, то ясно, что водород окисляется, но неизвестно, что восстанавливается. Более того, восстановление кислорода при переходе его из свободного состояния в соединение с другими элементами противоречит термину "восстановление".
Термин окисление-восстановление часто употребляется в нарушение законов логики: обширному кругу химических реакций, происходящих с изменением валентности, присвоено название, охватывающее лишь частный случай - присоединение или отнятие кислорода. Отсутствие особого термина для окислительно-восстановительных процессов является причиной огромных трудностей и для преподавателей, и для учащихся средней и высшей школы при изучении ими химии.
Для получения водорода учащиеся пользовались простым прибором, действующим по принципу аппарата Киппа. В лабораторной практике применяется несколько видов приборов, действующих по тому же принципу. Чтобы этот принцип стал достаточно ясным для учащихся, следует сравнить несколько таких приборов в натуре или их рисунков, а в заключение показать и самый аппарат Киппа заводского изготовления. Для лучшего понимания его устройства нужно показать его в разобранном и собранном виде. Активу учащихся можно предложить самим придумать прибор, действующий по принципу аппарата Киппа.
О способе получения водорода на заводах можно рассказать после ознакомления учащихся с применением водорода, когда они узнают потребности в нем химической промышленности. О нахождении водорода в природе учащиеся могут узнать самостоятельно из учебника. Дополнительные сведения учитель может сообщить на заключительной беседе после выполнения учащимися самостоятельной работы с учебником на уроке. Эту работу учащиеся могут выполнять по плану, который сходен с планом их работы по теме "Кислород в природе".
Для сокращения записей и большей наглядности следует рекомендовать учащимся составить схему нахождения водорода в природе. Для этого нет надобности рисовать вещества, в которых содержится водород, а достаточно начертить клетки и написать в них названия веществ или предметов (вода, растения и т. д.). Так же можно нарисовать и схему применения водорода, указывая те отрасли народного хозяйства, где применяется водород. После изучения водорода следует показать фильм "Водород и его применение".
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'