
Вода
К началу изучения этой темы учащиеся уже располагают значительным запасом сведений о воде, полученных ими на уроках естествознания, биологии, физики и химии, Однако их знания весьма поверхностны, так как учащиеся знают лишь внешнюю сторону явлений, не понимая физико-химической сущности их. Поэтому одна из задач преподавания по данной теме состоит в углублении и приведении в определенную систему знаний учащихся на основе атомно-молекулярной теории. Второй задачей темы является усвоение учащимися новых знаний: о химических свойствах воды, о ее роли в жизни животных и растительных организмов, об участии ее в некоторых явлениях, происходящих в неживой природе.
Знание учащимися химических свойств воды позволяет правильно оценить ее роль в природе, увидеть в этом веществе достаточно активный химический реагент, принимающий участие в процессах минералообразования, в развитии живых организмов.
При изучении воды, как и других веществ, необходимо развивать и подкреплять примерами основную идею курса химии - выявление роли этой науки в познании и преобразовании природы для улучшения, материальных условий жизни человека, не следует упускать случая выявить отрицательную роль религиозных учений, суеверий в изучении такого важнейшего для человека вещества, каким является вода. Изучение воды можно вести по следующему плану: состав воды, физические и химические свойства, вода как растворитель, роль воды в природе и использование ее человеком.
При изучении водорода учащиеся узнают состав воды на основании синтеза ее из элементов.
Состав воды. Чтобы показать учащимся с тем, что при изучении состава веществ применяется не только синтез, но и анализ, их следует ознакомить с определением состава воды, способом ее разложения на элементы. С этой целью принято демонстрировать опыт электролиза водного раствора серной кислоты или едкого натра.
Из всех многочисленных приборов, предлагаемых для осуществления этой реакции, лучшим следует признать прибор Гофмана с платиновыми электродами, а источником тока - аккумуляторы. Однако в школьной практике прибор Гофмана быстро выходит из строя вследствие поломки тонких платиновых проводов, впаянных в стеклянные трубки, а аккумуляторы очень громоздки, если учесть, что нужно пользоваться несколькими последовательно соединенными аккумуляторами. Поэтому в школьной практике применяются самодельные приборы, состоящие из электролизера и содово-алюминиевого выпрямителя. Один из таких приборов, представляющий комбинацию электролизера и выпрямителя, изображен на рисунке 43. В стеклянную банку 1 наливают 1-4-процентный раствор бикарбоната натрия, калия или аммония. Растворы должны приготовляться на дистиллированной воде. Банку закрывают деревянной крышкой 9, через которую проходят два стержня: один железный 2, другой алюминиевый 3. Первый проходит через пробку 7 электролизера и является в одно и то же время и электродом и штативом, поддерживающим электролизер. Второй электрод 4 тоже железный. В качестве электролита берут раствор едкого натра или едкого кали. К электроду 4 и алюминиевому стержню 3 присоединяют электрические провода 8, при помощи которых прибор включается в электросеть переменного тока. Этот прибор может быть изготовлен самими учащимися.
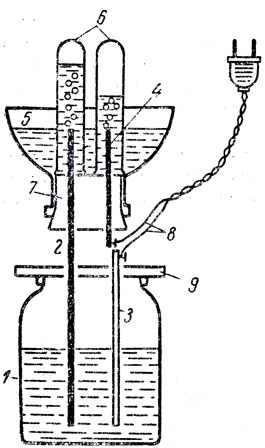
Рис. 43. Комбинированный прибор, применяемый в качестве выпрямителя или электролизера
Заканчивая изучение состава воды, учитель еще раз обращает внимание учащихся на то, что формулы веществ не придумывают, а находят на основе химических опытов - синтеза и анализа.
Свойства воды. Физические свойства воды хорошо известны учащимся. Подходя к изучению химических свойств, учитель обращает внимание на то, что вода - сложное вещество и ей свойственны реакции разложения, замещения и соединения. При ознакомлении с реакцией разложения воды следует заметить, что молекулы воды обладают большой термической стойкостью. Для изучения реакции замещения водорода атомами металлов в молекулах воды можно рассмотреть вначале действие на воду таких металлов, окислы которых нерастворимы или плохо растворимы в воде. В этом случае учащиеся могут наблюдать выделение водорода и видеть второй продукт реакций - окисел. С этой целью можно показать действие водяного пара на цинковую пыль, или на стружки магния, или на порошкообразное восстановленное железо. Опыт действия водяного пара на цинковую пыль описан в учебнике.
Опыт проходит более удачно, если прибор собрать так, как показано на рисунке 44. Воду и порошок цинка надо поместить в изогнутую пробирку 1. Во избежание переброса воды из пневматической ванны в пробирку, следует включить в прибор предохранительную пробирку 2 с двумя газоотводными трубками. Пробирку 2 можно заменить небольшой склянкой. Для собирания водорода следует заготовить 2-3 пробирки, наполненные водой.
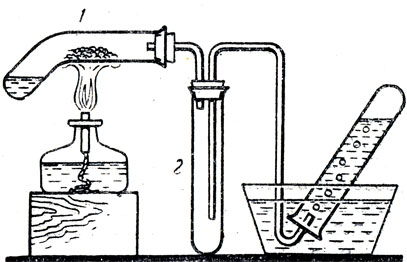
Рис. 44. Взаимодействие водяного пара с цинковой пылью
Соединение воды с окислами. Химическую активность воды можно показать на примере гидратации окислов. Вначале следует рассмотреть взаимодействие воды с кислотными окислами, так как продукты этих реакций кислоты в какой-то мере известны учащимся. Наиболее простой (для понимания учащихся) реакцией является гидратация серного ангидрида. Если этого окисла нет в лаборатории, то можно показать опыт гидратации фосфорного ангидрида. Химизм этой реакции доказывается ее тепловым эффектом и образованием кислоты. Последнее устанавливается с помощью индикатора. Менее эффективным, но более доступным для анализа является опыт гидратации двуокиси серы, некоторые свойства которой известны учащимся (при изучении свойств кислорода они получали этот окисел). В качестве примера гидратации окислов металлов можно показать опыт гашения извести.
В этом опыте нужно выделить две стадии: реакцию соединения окиси кальция с водой и растворение гидрата в воде. Раствор испытывают индикатором, сравнивают изменение окраски его с тем, что наблюдалось при испытании кислот. На этом же уроке следует ввести термин "щелочь" и поставить задачу изучения этого класса веществ.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'