
Основания
В соответствии с общим планом изучения отдельных классов неорганических веществ основания должны рассматриваться в такой последовательности: а) состав и свойства важнейших представителей щелочей, б) нерастворимые основания, в) общая характеристика оснований. При этом нужно иметь в виду, что при изучении кислот, окислов и солей будет пополняться химическая характеристика оснований. Из растворимых оснований рассматриваются в курсе химии средней школы едкий натр, едкое кали, гидроокись кальция.
Гидроокись натрия. В результате изучения этого вещества на первом занятии учащиеся должны приобрести следующие знания.
Молекула гидроокиси натрия состоит из трех атомов и обозначается формулой NaOH. Это твердое вещество белого цвета, хорошо растворимое в воде, при растворении выделяется много теплоты. Раствор едкого натра мылкий на ощупь, разъедает ткани животного и растительного происхождения. Раствор лакмуса от действия его принимает синий цвет, а раствор фенолфталеина - малиновый.
Учащиеся должны приобрести знания и умения осторожно обращаться с этим веществом и его растворами.
Первый урок, посвященный изучению едких щелочей, следует провести, сочетая беседу с демонстрациями опытов и ученическим экспериментом. Такая форма учебной работы рекомендуется потому, что свойства едкого натра лучше познаются учащимися при непосредственном наблюдении образцов этого вещества и при выполнении опытов растворения и испытания раствора индикатором; так как обращение с твердым едким натром и его растворами небезопасно для начинающих изучать его, то ученическим опытам должны предшествовать демонстрации наиболее опасных опытов и объяснения, как учащимся производить указанные в задании опыты. Если к самостоятельным работам учащимся выдана одна общая инструкция, то выполнять ее следует по частям, с дополнительными устными указаниями и демонстрациями учителя.
Прежде всего нужно ознакомить учеников с планом изучения едких щелочей вообще и едкого натра в частности. Этот план может быть дан в форме приведенной ниже таблицы, которая должна служить и формой ученического отчета.

Таблица 11. Состав и свойства щелочей
Учитель предупреждает учащихся, что в эту таблицу они будут заносить сведения о трех веществах. Для заполнения первых четырех граф учащимся предлагается рассмотреть образец твердого едкого натра, находящегося в закрытой баночке, прочитать формулу и названия, написанные на этикетке. После, выборочной проверки записей учитель рассказывает и показывает, как проводить опыт растворения едкого натра и какие могут быть несчастные случаи при неосторожном обращений с ним (указывает, что нужно делать, если такой случай произойдет). После этого дается, следующая инструкция: для ознакомления с растворимостью едкого натра в воде, возьмите пинцетом кусочек едкого натра, опустите в пробирку и влейте столько воды, чтобы он был погружен в воду. Наблюдая за растворимостью этого вещества, отметьте, разогревается или охлаждается то место пробирки, где происходит растворение едкого натра.
После краткого обсуждения результатов опытов предлагается узнать, какие изменения происходят с двумя веществами - лакмусом и фенолфталеином при действии на них раствора едкого натра. Учитель показывает, как проводить этот опыт.
После этого учащиеся читают инструкцию: "На стеклянную пластинку положите две полоски фильтровальной бумаги: одна из них пропитана раствором лакмуса и имеет сине-фиолетовый цвет, вторая пропитана бесцветным раствором фенолфталеина. С помощью стеклянной трубочки перенесите по капелькам раствор едкого натра из пробирки на полоски бумаги и отметьте изменение окраски бумажных полосок. Результаты наблюдений запишите в таблицу", - и выполняют опыт.
Последний опыт - действие на шерстяную нить - учащиеся могут выполнить без дополнительного пояснения учителя, пользуясь только написанной инструкцией.
"В пробирку с раствором едкого натра опустите шерстяную, нить и оставьте ее на несколько минут, которые используйте для чтения учебника и внесения исправлений и дополнений в сделанные вами записи. На основе наблюдений и чтения учебника, заполните последнюю графу таблицы".
Гидроокись калия. При наличии в школе достаточного количества гидроокиси калия следует провести изучение этого вещества по тому же плану и при аналогичной инструкции, но без дополнительных устных указаний. Такая работа является хорошим способом закрепления знаний о едком натре и усовершенствовании умений обращаться с едкими щелочами.
После ознакомления с составом двух щелочей можно начата формирование понятия о гидроксиле как о водном остатке.
С этой целью нужно сравнить структурные формулы воды, едкого натра и едкого кали, чтобы учащиеся заметили в них сходство и различие. Из этой беседы возникнет потребность постановки опыта - действия металла натрия на воду.
Этот опыт лучше произвести в широкой пробирке, чтобы можно было поджечь выделяющийся водород (рис. 50). Чтобы доказать, что в растворе остается едкий натр, раствор испытывают индикатором и часть его выпаривают.
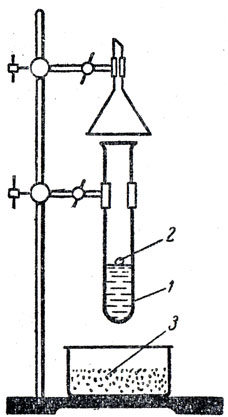
Рис. 50. Взаимодействие натрия с водой: 1 - пробирка с водой, 2 - маленький кусочек натрия, 3 - чашка с песком
Разумеется, для научной цели таких доказательств состава, молекулы едкого натра было бы недостаточно, но для учебных целей можно ограничиться и таким обоснованием формулы едкого натра. Все это лучше догматического сообщения, тех же сведений.
Гидроокись кальция. Так как учащиеся обладают значительным запасом сведений об извести и известковой воде, то их самостоятельная работа может проходить успешно по заданию (без дополнительного пояснения учителя). В заключительной беседе следует рассмотреть взаимодействие, окиси кальция с водой и ввести термин "гидроокись кальция", объяснив, однако, что в молекуле едкого кальция нет целых молекул воды.
Обобщая результаты изучения трех оснований, важно обратить внимание на нахождение в составе их молекул гидроксильных групп и объяснить этим сходство таких свойств, как действие на индикаторы. Кроме того, важно отметить соответствие валентности металла количеству гидроксильных групп, соединенных с одним атомом этого металла.
Затем формулируется определение: "Щелочи - растворимые в воде вещества, молекулы которых содержат гидроксильные группы, соединенные с атомами металлов".
После этого следует предложить экспериментальную задачу: "В трех пробирках находятся растворы: в одной - поваренной соли, в другой - едкого аммония, а в третьей - раствор другой щелочи. Определить, в какой пробирке, что растворено".
Нерастворимые основания. Для характеристики нерастворимых оснований и подтверждения их названия "гидраты окислов металлов", или "гидроокиси металлов", важно знать одно из общих их свойств - разложение при нагревании на окисел и воду.
Для изучения этого свойства можно осуществить разложение гидроокиси меди, которое происходит при сравнительно невысокой температуре, а продукты этой реакции - окись меди и вода, хорошо известные учащимся, легко обнаруживаются. Эта реакция как бы подтверждает, что данное основание действительно является гидратом. Но тут же нужно предупредить учащихся, что обратная реакция - гидратация окиси меди не происходит. Можно продемонстрировать или предложить им выполнить соответствующий опыт. Аналогичные опыты следует проводить и при изучении гидроокиси железа.
Опыты проходят хорошо, если гидроокиси хорошо промыты (освобождены от примесей щелочей, которыми пользуются при их получении) и просушены.
Изучение нерастворимых оснований успешно проходит в случае применения самостоятельной работы по заданию.
Состав и свойства нерастворимых оснований
Цель работы.
1. Выяснить общее в составе и свойствах нерастворимых оснований.
2. Сходство и различия между щелочами и нерастворимыми основаниями.
В качестве примеров нерастворимых оснований следует изучить состав и свойства двух оснований - гидроокиси меди и гидроокиси железа. Ознакомьтесь с внешним видом этих веществ и проделайте описанные ниже опыты.
Результаты наблюдений можете записать в форме таблицы, в которой должны быть следующие графы: 1) номер по порядку, 2) название, 3) формула, 4) краткое описание внешнего вида, 5) результаты испытаний лакмусом и фенолфталеином, 6) результаты нагревания небольшого количества вещества на стеклышке или на пластинке из белой жести.
Изучение гидроокиси меди.
1. Рассмотреть образец гидроокиси меди и заполнить графы 1-4 в таблице.
2. Поместить часть изучаемого вещества в пробирку, прилить чистой воды, взболтать и испытать полученную жидкость индикаторами (как испытывали раствор щелочи). Результаты записать в таблице.
Разложение гидроокиси меди. Небольшое количество испытуемого вещества поместите на пластинку из белой жести и подержите над пламенем горелки. Какие вещества получились? Почему так думаете? Напишите уравнение этой реакции. Проверьте правильность ваших записей по учебнику. Заполните графу 6 вашей таблицы. Узнайте, гидратируется ли окись меди.
Изучение состава и свойств гидроокиси железа следует проводить в том же порядке, в каком вы изучали гидроокись меди, и также заполнить все графы этой таблицы.
Сравнение состава и свойств щелочей и нерастворимых оснований.
1. Выясните из содержания таблиц, что является общим в составе всех оснований, растворимых и нерастворимых. Сформулируйте определение оснований.
2. Укажите общие свойства нерастворимых оснований.
3. Укажите общие свойства растворимых оснований.
4. Проверьте по учебнику правильность и полноту этих записей.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'