
Кислоты
При решении вопроса, какие кислоты следует изучать, необходимо иметь в виду следующее: 1) формирование понятия о классе кислот, 2) связь обучения с жизнью, и в частности задачи политехнического образования. Для формирования понятия о кислоте необходимо рассматривать такие кислоты, при изучении которых можно было бы выделить общие существенные признаки. При этом следует рассмотреть некоторые варьирующие, но важные признаки, свойственные большому количеству кислот. Общим признаком всех кислот является их взаимодействие со щелочами (реакция нейтрализации).
К важным (но не общим) признакам относятся: взаимодействие кислот с металлами с выделением водорода, действие на лакмус, жидкое состояние, растворимость в воде. Исходя из этого следует рассмотреть кислоты: соляную, азотную, фосфорную, стеариновую. Вопрос о последовательности изучения кислот должен решаться на основе дидактического правила перехода от простого к сложному. Наиболее простой состав имеет соляная кислота. Для нее, как для сильной кислоты, наиболее типичны окислительные свойства иона водорода.
Соляная кислота. Изучение кислот целесообразно начинать с самостоятельной работы учащихся. В начале занятий учитель разъясняет задачи обучения по этой теме, общий план работы и предлагает начертить таблицу, которая может служить планом выполнения опытов, а ее заполнение - отчетом по этой работе.
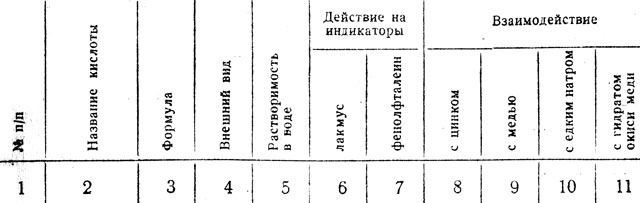
Таблица 12. Состав и свойства кислот
Для правильного понимания учащимися соляной кислоты как раствора хлористого водорода в воде необходимо показать: 1) что хлористый водород хорошо растворим в воде; 2) что его растворимость, как и всех газов, уменьшается с повышением температуры. Поэтому в беседе, предшествующей самостоятельной работе учащихся, необходимо показать опыт растворения хлористого водорода (фонтан) и назвать концентрацию кислоты, находящейся на столе учителя, и тех растворов, которые даны учащимся для их самостоятельной работы. Об уменьшении растворимости хлористого водорода при уменьшении давления и повышении температуры учащиеся могут судить, наблюдая образование тумана при открывании учителем склянки с концентрированной соляной кислотой. О составе этого тумана учитель должен сообщить учащимся. Рассматривая соляную кислоту как раствор хлористого водорода в воде, нужно сопоставить концентрацию раствора и плотность его. При этом следует сообщить, что концентрированная соляная кислота содержит около 40% хлористого водорода, а в продажу поступает кислота, имеющая плотность 1,19, содержащая около 37% НСl.
В Дальнейшее изучение свойств соляной кислоты учащиеся могут вести самостоятельно по заданию, приведенному ниже. Физические свойства. В склянке с надписью НСl находится соляная кислота. Ознакомьтесь с ее состоянием и внешним видом. Заполните графы 3, 4 и 5 таблицы.
Растворимость в воде. В одну из пробирок влейте воды на 1/4 ее объема. Стеклянной трубочкой перенесите несколько капель соляной кислоты в пробирку с водой. Обратите внимание на появление тумана над горлышком раскрытой склянки с соляной кислотой. Отметьте, как растворяется соляная кислота в воде. Не нагревается ли пробирка? Заполните графу 5 таблицы.
Действие соляной кислоты на Лакмус. Стеклянной трубочкой перенесите по одной капле раствор кислоты на синюю лакмусовую бумажку и на бумажку, пропитанную раствором фенолфталеина. Бумажки должны лежать на стеклянной пластинке. Результаты испытания запишите в графе 6 таблицы. Как отличить раствор кислоты от раствора щелочи?
В беседе по этой части лабораторной работы можно ввести термин "индикаторы". Дальнейшее ознакомление с химическими свойствами соляной кислоты можно начать с реакции замещения водорода металлом. Для этой цели рекомендуется показать опыт взаимодействия концентрированной соляной кислоты с металлическим натрием.
Опыт проводить можно в том же приборе, в котором демонстрировали взаимодействие воды с натрием (см. рис. 50). Для опыта нужно брать и опускать в пробирку с кислотой маленькие кусочки натрия. Выделяющийся водород следует поджечь. Хлорид натрия, будучи плохо растворим в концентрированной соляной кислоте, быстро оседает на дно пробирки в виде мелких кристалликов. Эти кристаллики можно отделить от кислоты фильтрованием и промыть на фильтре, насыщенным раствором хлорида натрия, а затем показать учащимся. После этого учащиеся могут продолжать самостоятельную работу по второй части задания.
Действие цинка на кислоту. В пробирку с раствором кислоты опустите кусочек цинка. Наблюдайте выделение газа. Подожгите выделяющийся газ. Запишите уравнение реакций кислоты с цинком, зная, что цинк двухвалентен. (Вспомните получение водорода в лаборатории.)
Все ли металлы так реагируют с соляной кислотой? Опустите в раствор соляной кислоты кусочек медной проволоки. Происходит ли реакция?
Заполните графы 8 и 9 таблицы и проверьте ваш вывод по учебнику.
При разборе реакции замещения водорода в кислоте металлами учитель обращает внимание учащихся на то, что в растворе остаются хлористые металлы, которые можно рассматривать как продукты замещения водорода в кислоте металлами. Не вводя определение понятия "соли", можно называть хлористые металлы "хлористыми солями" по аналогии с хлористым натрием. После этого можно перейти к изучению более сложной химической реакции - взаимодействия соляной кислоты с основанием. Изучение этой реакции принято начинать с наблюдения и анализа опыта нейтрализации соляной кислоты едким натром. Обосновать это можно тем, что учащимся хорошо известны как вещества, вступающие в реакцию, так и вещества, получающиеся в результате реакции. Однако в этом процессе учащиеся не наблюдают изменения хотя бы одного из реагирующих веществ и отмечают лишь конец реакции по изменению окраски индикатора. Более наглядным является процесс нейтрализации соляной кислоты гидроокисью меди. Этот опыт могут выполнять учащиеся. Как реагирует соляная кислота с гидроокисью меди? Чтобы ответить на этот вопрос, проделайте опыт. В фарфоровую чашечку поместите небольшое количество гидроокиси меди и прибавляйте по каплям раствор кислоты до растворения гидрата. Обратите внимание на цвет полученного раствора. Сравните его с цветом раствора хлорной меди. Какое предположение можно сделать о том, какая реакция произошла между кислотой и основанием? Напишите уравнение предполагаемой реакции. Проверьте правильность записанного по учебнику.
Для ознакомления учащихся с нейтрализацией кислоты щелочью лучше сначала учителю показать опыт, а затем предложить учащимся повторить его с малым количеством реактивов. Перед демонстрацией этого опыта учитель показывает подготовительный опыт для сравнения цвета лакмуса в кислой, щелочной и нейтральной среде: в три одинаковые колбочки, содержащие равные объемы растворов кислоты, щелочи и соли, приливает по равному количеству раствора лакмуса и предлагает сравнить цвет получившихся растворов. Эти колбочки остаются на демонстрационном столе. Затем в такую же колбочку наливает раствор соляной кислоты, добавляет лакмус и титрует раствором едкого натра, сравнивая время от времени цвет полученного раствора с цветом кислого, щелочного и нейтрального растворов. После нейтрализации полученный раствор выпаривает. А учащиеся в это время проделывают свои опыты по заданию.
Взаимодействие соляной кислоты с едким натром.
В фарфоровую чашечку влейте 1-2 мл раствора соляной кислоты и добавьте одну каплю раствора лакмуса. Заметьте окраску лакмуса.
С помощью пипетки или стеклянной трубочки возьмите раствор едкого натра из склянки и прибавляйте его по каплям в чашечку с кислотой и наблюдайте изменение цвета раствора. Когда цвет станет фиолетовым, прекратите приливание раствора кислоты. Для сравнения прибавьте несколько капель раствора лакмуса в другую пробирку с чистой водой или с раствором поваренной соли. Сравните цвет этих растворов.
Напишите уравнение реакции, происшедшей между кислотой и щелочью. Опишите кратко опыт нейтрализации кислоты Щелочью и решите задачу: "В трех пробирках находятся: в одной - вода, в другой - раствор щелочи, в третьей - раствор кислоты. Определите, в какой из них находится кислота, а в какой щелочь. Как вы узнали это?"
После этого учитель проводит краткую обобщающую беседу, включающую упражнения в написании уравнений реакций нейтрализации.
Серная кислота. Следуя общему плану изучения кислот, учитель может начать первый урок, на тему "Серная кислота" с краткого повторения результатов изучения соляной кислоты, обращая особое внимание на план ее изучения. Знания о свойствах серной кислоты учащиеся могут приобрести, выполняя соответствующие наблюдения и опыты, читая учебник. Но самостоятельной работе учащихся следует предпослать краткую беседу с демонстрацией некоторых опасных или сложных опытов.
При демонстрации опытов с концентрированной серной кислотой учитель должен при всяком удобном случае разъяснять учащимся, как нужно обращаться с этим веществом.
При ознакомлении учащихся с физическими свойствами серной кислоты следует отметить: а) ее состояние при обычных условиях (маслообразная жидкость, "купоросное масло"); б) сравнительно большую плотность; в) высокую температуру кипения; г) гигроскопичность.
Чтобы показать, что серная кислота - маслообразная жидкость, учитель может перелить тонкой струей некоторое количество кислоты из склянки в стакан. Так как в большинстве химических кабинетов нет такого количества ареометров, чтобы каждый учащийся мог измерить им плотность серной кислоты, а показания ареометра плохо видны на значительном удалении от прибора, то рекомендуется знакомить учащихся с плотностью серной кислоты с помощью взвешивания. С этой целью можно уравновесить два стеклянных цилиндра емкостью в 200 мл каждый, затем в один влить 100 мл концентрированной серной кислоты, а в другой столько воды, чтобы снова наступило равновесие. Если в первом цилиндре кислота чистая, то во втором цилиндре окажется 184 мл воды. Таким образом, учащиеся убедятся, что 100 мл чистой серной кислоты весят столько же, сколько 184 мл воды; это значит, что плотность серной кислоты
| 184 | = 1,84* | |
| 100 |
* (Для демонстрации опыта определения плотности серной кислоты удобен прибор ареоскоп. См. рис. 1 и описание способа его применения.)
Пользуясь весами, можно показать и большую гигроскопичность серной кислоты. Для этого наливают в широкий стакан или в чашечку Петри концентрированную серную кислоту, уравновешивают на технохимических весах и оставляют весы неарретированными на некоторое время. Минут через пять после этого обнаруживается увеличение веса чашечки с кислотой вследствие поглощения ею влаги из воздуха.
О сравнительно высокой температуре кипения кислоты можно только сообщить, так как демонстрация этого опыта сложна, небезопасна, а результат опыта плохо видят учащиеся с мест.
При ознакомлении с растворимостью серной кислоты нужно обратить внимание на сильное повышение температуры раствора, что можно определить с помощью термоскопа. Этот опыт нужно использовать для объяснения того, как нужно растворять концентрированную серную кислоту в воде, и для напоминания о мерах предосторожности при обращении с концентрированными растворами кислот и щелочей. Необходимо напомнить о способах оказания первой помощи при несчастных случаях в химической лаборатории.
Результаты наблюдений показанных учителем опытов и его сообщения о составе и свойствах серной кислоты заносят в графы 1-4 таблицы. Дальнейшее изучение свойств этого вещества может проходить при самостоятельной работе учащихся по заданию.
Химические свойства серной кислоты. С помощью стеклянной трубки перенесите по капле раствора кислоты на лакмусовую и фенолфталеиновую бумажки и отметьте действие кислоты на эти индикаторы.
Действие разбавленной серной кислоты на металлы. Испытайте действие разбавленной серной кислоты на цинк и медь. Опыт проделайте так, как вы поступали при изучении соляной кислоты. Запишите уравнения реакций. Сравните свойства соляной и серной кислот.
Взаимодействие серной кислоты с гидроокисью меди. Опыт проделайте так, как вы поступали при изучении взаимодействия соляной кислоты с гидроокисью меди. Напишите уравнение реакции.
Нейтрализация серной кислоты едким натром. Опыт проделайте так же, как вы нейтрализовали соляную кислоту едким натром. Выпаривать полученный раствор не надо.
Заполните все графы в таблице, проверьте записи по учебнику. Напишите уравнения реакций, происходящих между: а) серной кислотой и едким кальцием, б) серной кислотой и гидроокисью железа.
Сравнивая уравнения реакций серной кислоты с основаниями, следует обратить внимание на то, что группа атомов SO4 не разлагается и переходит как целое в молекулы сернокислых металлов. Эту группу следует назвать кислотным остатком, сформулировать его определение, отметить его валентность.
После этого следует ознакомить учащихся с некоторыми особыми химическими свойствами серной кислоты, например с разрушающим действием ее на ткани животного и растительного, происхождения. Для иллюстрации можно показать опыты: действие концентрированной кислоты на бумагу, на ткани - и еще раз напомнить о необходимости осторожного обращения с серной-кислотой. Уравнение реакции писать не следует. Сравнивая состав серной и соляной кислот, следует обратить внимание учащихся на наличие кислорода в серной кислоте, а затем сообщить, что при сильном нагревании серной кислоты происходит разложение ее молекулы на два окисла: трехокись серы и воду. Теперь же уместно ввести термин "ангидрид", Сопоставив уравнения реакций разложения молекул основания и серной кислоты, можно по аналогии назвать и серную кислоту гидратом окиси серы.
Краткую беседу о применении серной кислоты следует связать с повторением ее свойств: гигроскопичности, высокой температуры кипения, химических свойств. В соответствии с этим можно рассказать об использовании серной кислоты для поглощения воды, получающейся при некоторых химических реакциях, для получения соляной кислоты, для нейтрализации щелочей, растворения окислов металлов.
Необходимо обратить внимание учащихся на то, что серная кислота является важным веществом для химической и оборонной промышленности, для производства минеральных удобрений. На изучение серной кислоты достаточно отвести два урока.
Азотная кислота. План изучения азотной кислоты в основном тот же, что и для изучения серной кислоты. Для ознакомления с физическими свойствами нужно показать чистую, бесцветную кислоту и дать объяснение, почему азотная кислота часто имеет бурую окраску.
При изучении химических свойств азотной кислоты следует уделить особое внимание реакциям, происходящим при действии ее на металлы. Следует показать опыт взаимодействия этой кислоты с медью. Не записывая уравнений реакций, нужно указать, что в результате их получаются тоже соли, но выделяется не водород, а другие газы. Изучение этой кислоты успешно проходит по тому же плану и по аналогичному заданию.
Обращается особое внимание учащихся на результаты взаимодействия азотной кислоты с цинком и медью. Для нейтрализации азотной кислоты щелочью лучше воспользоваться едким кали и реакции проводить со средними концентрациями кислоты и щелочи, чтобы получить при упаривании кристаллы азотнокислого калия, растворимость которого сильно снижается при охлаждении раствора. В результате этой работы учащиеся должны сделать выводы, ответив на вопросы: в чем сходство и в чем различие между изученными тремя кислотами? Какая химическая реакция является общей для изученных кислот?
В заключительной беседе после самостоятельного изучения учащимися азотной кислоты следует еще раз возвратиться к формированию понятия о кислотном остатке и об основности кислот. Отмечая особенности азотной кислоты, следует рассказать, о применении азотной кислоты в производстве взрывчатых веществ.
Состав и общие свойства кислот. Чтобы отметить общие свойства кислот, нужно подобрать образцы кислот в дополнение к ранее изученным. Многие учащиеся, имея дело только с жидкими кислотами и их растворами, полагают, что жидкое состояние и хорошая растворимость в воде являются общими свойствами всех кислот. С целью предупреждения этой ошибки нужно показать образцы твердых растворимых и нерастворимых кислот, например ортофосфорную, борную, стеариновую. Точно так же следует уточнить представления учащихся о действии этих кислот на индикаторы: они должны знать, что обнаружить кислоту индикатором можно только в растворе.
После демонстрации опытов с этими кислотами и записей результатов наблюдений в таблицу следует анализ всех записей для выявления общего в составе и свойствах кислот. На основе сравнения следует вывод, что общим для всех кислот является наличие атомов водорода в молекулах всех кислот и взаимодействие их с основаниями.
Этого достаточно для того, чтобы учащиеся при помощи учителя сформировали следующее определение: кислоты - сложные вещества, содержащие водород, реагирующие с основаниями с образованием соли и воды.
Если произвести анализ реакций нейтрализации на основе атомно-молекулярной теории, то учащиеся могут характеризовать эту реакцию как взаимодействие водорода кислоты с гидроксилом щелочи. Эту трактовку нейтрализации можно включить в определение кислоты. Тогда это определение должно формулироваться так: кислоты - сложные вещества, содержащие водород, атомы которого могут соединяться с гидроксилами оснований. Эта формулировка ближе к той, которая будет дана определению кислоты на основе теории электролитической диссоциации.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'