
Изучение периодического закона и системы химических элементов (второй вариант на основе строения атомов)
Описанная выше последовательность изучения периодической системы и электронной теории строения атома соответствует истории открытия периодического закона и разработке электронной теории. Дидактический анализ изложенной методики обучения по этим двум темам, которые много лет изучались как одна тема, и педагогическая практика вскрыли ряд значительных недостатков в таком способе изучения периодического закона и периодической системы.
Учащиеся до ознакомления с электронной теорией строения вещества не могут понять закономерностей, на основе которых построена периодическая система. Не могут объяснить тех исключений, которые допущены в периодической системе при определении места некоторых химических элементов, и, наконец, сама основа классификации в современной периодической системе иная - не атомная масса, а заряд атомного ядра. Поэтому необходимо рассматривать периодический закон как до изучения электронной теории, так и после изучения ее.
Для обоснования этого закона можно привести схемы строения атомов, которые ясно показывают периодичность в изменении строения атомов, если рассматривать их в порядке возрастания зарядов атомных ядер. Все это вызывает потребность в изменении последовательности изучения периодической системы и электронной теории строения атомов. Чтобы подготовить учащихся к выводу периодического закона, необходимо повторить свойства простых веществ, материал о строении атома, изучавшийся в курсе физики. Для этого учащиеся получают домашнее самостоятельное задание, состоящее из следующих вопросов:
1. Из каких элементарных частиц состоят атомы?
2. Как располагаются электроны вокруг ядра? Дайте схемы строения атомов водорода, гелия и лития (схемы помещены в учебнике физики).
3. Что такое электронный слой? Сколько электронов находится на первом электронном слое у атома лития? И т. д.
Для вывода периодического закона учитель использует один из приемов, описанных в первом варианте, но теперь он рассказывает и о строении атома. Особенно удобно использовать карточки, которые располагают на нитках или проволоке в порядке увеличения зарядов атомных ядер (на обратной стороне карточки делают язычок из бумаги, за который они подвешиваются).
Целесообразно постепенно увеличивать размер этих карточек в связи с возрастанием заряда атомных ядер при переходе от водорода к другим элементам, что будет рельефно отмечать расположение элементов в порядке увеличения зарядов их атомов (рис. 52). В верхней части карточек римской цифрой показывают валентность элементов по кислороду, а в нижней части - атомные массы. Чтобы оттенить нулевую валентность инертных газов, карточки для них делают в виде кругов. Для наглядности карточки с элементами, обладающими металлическими свойствами, окрашивают в синий цвет, а с неметаллическими свойствами - в красный цвет. Карточки с элементами, соединения которых обладают амфотерными свойствами, наполовину окрашивают в синий и красный цвета. Карточки с инертными газами не окрашивают.
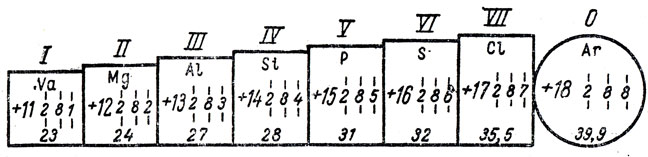
Рис. 52. Расположение элементов в порядке увеличения зарядов атомных ядер
При рассмотрении этих карточек учитель обращает внимание учащихся на то, что при равномерном увеличении зарядов ядер атомов через определенное количество элементов наблюдается закономерное повторение строения электронных слоев (строение электронных слоев изменяется периодически при линейном увеличении зарядов атомных ядер). Как же в связи с этим изменяются свойства химических элементов? В процессе беседы с учащимися выясняется, что при линейном росте зарядов атомных ядер периодически изменяется структура электронных слоев, в связи с чем периодически изменяются и свойства простых веществ. Затем рассматривают свойства соединений химических элементов (окислов, их гидратов - оснований и кислот) и отмечают, что и свойства соединений химических элементов находятся в периодической зависимости от величины зарядов атомных ядер. Учащимся становится понятным, что при линейном увеличении зарядов атомных ядер периодически меняется строение электронных слоев атомов, поэтому периодически изменяются и свойства химических элементов и их соединений. На основе этого дается современная формулировка периодического закона: "Свойства химических элементов и их соединений находятся в периодической зависимости от величины зарядов их атомных ядер". Затем приводится краткая справка об открытии периодического закона, зачитывается (не для запоминания) подлинная формулировка периодического закона, данная Д. И. Менделеевым, изучается жизнь и деятельность ученого. Обращается внимание на то, что в силу развития науки XIX в. Д. И. Менделеев не мог знать причины периодичности в изменении свойств химических элементов и их соединений, но он предполагал, что эта периодичность заложена в строении вещества, и не следовал слепо в расположении элементов на основе увеличения атомных масс, когда это приходило в противоречие со свойствами химических элементов (Go-Ni, Те-I, Аr-К). Как оказалось позлее, в свете электронного строения атомов, здесь не было никакого отклонения от периодического закона.
При таком подходе к изучению периодического закона и системы химических элементов нисколько не умаляется роль Д. И. Менделеева в открытии этого закона. Более того, эта роль увеличивается, подчеркивается удивительная научная интуиция великого ученого, позволившая ему в некоторых случаях отойти от порядка расположения элементов на основе увеличения атомных масс, что впоследствии блестяще подтвердилось теорией строения атомов.
При изучении периодической системы можно воспользоваться карточками. Но объяснять следует на основе строения атомов, Учитель здесь испытывает затруднение в том, что учащиеся еще не знают металлических и неметаллических свойств химических элементов на основе электронного строения атомов, но можно предварительно сообщить им, что химические свойства типичных металлов обусловлены легкостью отдачи электронов их атомами, так как они не прочно соединены с ядром. На внешнем слое их находится 1-3 электрона. В атомах же неметаллов на внешнем слое находится больше электронов, которые прочнее связаны с ядром.
Изменение свойств в периодах объясняется тем, что практически размеры атомов остаются постоянными (не происходит прибавления новых электронных слоев), а растет число внешних электронов, поэтому их труднее отдать атому, в результате чего и нарастают неметаллические свойства элементов. В подгруппах же (главных) наблюдается увеличение размеров атомов (прибавляются новые электронные слои), но не изменяется число внешних электронов, в связи с этим электроны легче отрываются от атома (они более удалены от ядра, менее прочно с ним связаны), следовательно, с увеличением порядкового номера в этих подгруппах увеличиваются металлические свойства и, наоборот, падают неметаллические свойства. Это можно видеть на рисунке 53, где показаны сравнительные размеры атомов элементов, хорошо известных учащимся. В конце изучения этой темы учащимся можно дать упражнение по определению свойств элементов на основе положения их в периодической системе, например на основе места в периодической системе дать характеристику элементу № 20.
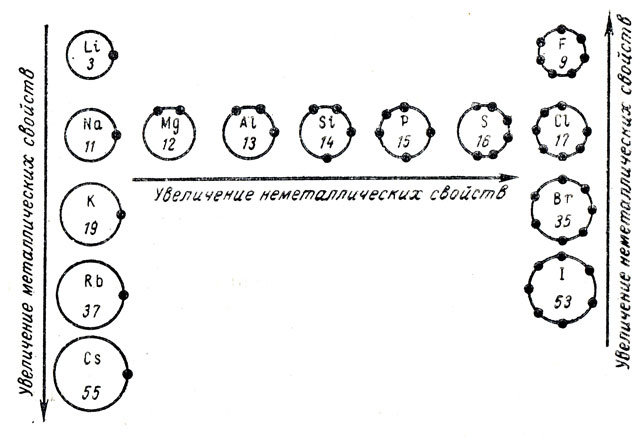
Рис. 53. Изменение свойств химических элементов в периодах и главных
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'