
Изучение периодического закона и системы химических элементов (первый вариант, до ознакомления с электронной теорией)
Подготовка учащихся к выводу периодического закона. Для уточнения того, что нужно повторить и какие дополнительные сведения необходимы учащимся для сознательного усвоения периодического закона, следует вспомнить менделеевскую формулировку этого закона. Свойства простых тел, также формы и свойства соединений элементов, находятся в периодической зависимости от величины атомных весов элементов. Как видно из этой формулировки, для вывода периодического закона необходимо знать прежде всего свойства простых веществ, т. е. элементов в свободном состоянии. Так как эти свойства необходимы для сравнения и установления закономерности в их изменениях, то желательно, чтобы они имели и качественную и количественную характеристику. Из качественной характеристики элементов имеет большое значение отношение их к кислороду, водороду и металлам. Важно знать сравнительную активность этих элементов, состав и характер высших солеобразующих окислов, гидроокиси, а также их соединения с водородом. К количественной характеристике свойств веществ следует отнести: атомные массы и плотность элементов, валентность их в соединениях с водородом и кислородом. До прохождения периодического закона учащиеся подробно изучали два элемента - водород и кислород. Кроме этого, они довольно поверхностно знакомились с некоторыми металлами и неметаллами (фосфор, сера, углерод, железо, цинк, магний, кальций, калий, натрий). Как видно, учащиеся имеют небольшой запас знаний о химических элементах, чтобы осознанно воспринимать периодический закон и систему химических элементов Д. И. Менделеева. Поэтому в программе рекомендуется дать только первое понятие о естественных группах химических элементов. Учащихся знакомят с физическими свойствами щелочных металлов (металлический блеск, твердость, температура плавления, плотность), с изменением этих свойств в связи с возрастанием атомных масс. После этого кратко изучают химические свойства щелочных металлов (взаимодействие с кислородом и водой). Учитель обращает внимание учащихся на то, что с увеличением атомных масс щелочные металлы проявляют и индивидуальные различия. После рассказа учителя, соответствующих демонстраций и беседы можно дать учащимся самостоятельную работу, при выполнении которой они делают определенные выводы о свойствах щелочных металлов в связи с изменением их атомных масс. Эту работу целесообразно оформить в виде таблицы, состоящей из следующих граф: название элемента, символ, атомная масса, температура плавления, плотность, продукты взаимодействия с кислородом, продукты взаимодействия с водой, валентность щелочных металлов. Порядок изучения группы галогенов примерно такой же: сначала рассматривают физические свойства галогенов, затем их важнейшие химические свойства (взаимодействие с водородом и натрием), выполняют самостоятельную работу, заполняя графы соответствующей таблицы.
Таким образом формируются понятия о естественных группах типичных металлов и неметаллов, отмечают их свойства в связи с изменением атомных масс этих элементов.
Вывод периодического закона. Основная задача урока на тему "Вывод периодического закона" состоит в том, чтобы обеспечить сознательное восприятие периодического закона, как обобщения того, что учащиеся узнали на предыдущих занятиях, составляя химические характеристики указанных выше элементов. Эту основную цель урока рекомендуется расчленить: показать, что свойства простых веществ находятся в периодической зависимости от величины атомных масс элементов; что свойства химических соединений находятся в зависимости от величины атомных масс элементов, входящих в состав этих соединений.
Сравнение свойств химических элементов лучше всего начать со сравнения валентности при расположении их в порядке возрастания атомных масс. В этом случае закономерности в изменении валентности выявляются особенно четко и могут быть выражены количественно. Можно предложить учащимся выполнить следующую работу. Через середину листа бумаги (в клетку) провести горизонтальную линию, в начале этой линии слева провести прямую, перпендикулярную к ней. На горизонтальной линии отложить отрезки, соответствующие атомным массам элементов, приняв каждую клетку (0,5 см) за единицу атомной массы. На вертикальной линии отложить отрезки, соответствующие валентности, приняв две клетки (1 см) за единицу валентности. Можно составить диаграмму, изображающую изменение валентности при увеличении атомных масс для первых трех периодов от водорода до аргона (рис. 51). Рассматривая эту диаграмму, прежде всего следует отметить, что в ряде элементов, расположенных по возрастанию атомных масс, валентность каждого последующего элемента отличается от предыдущего на единицу. Из этого следует, во-первых, что возрастание валентности идет равномерно, и, во-вторых, нет оснований для того, чтобы искать какой-то новый элемент, обладающий атомной массой, средней между атомными массами соседних двух элементов.
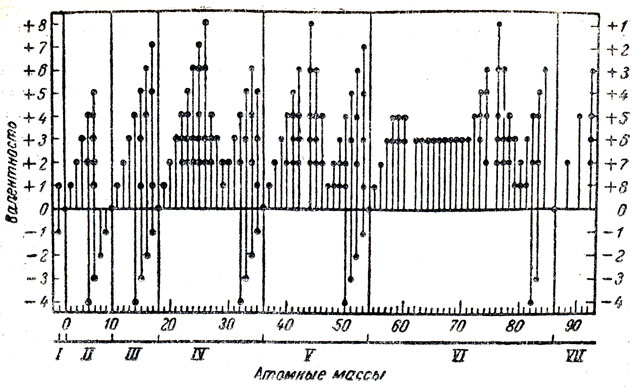
Рис. 51. Диаграмма изменений валентностей элементов
После того как учащиеся составят диаграмму изменения валентности для первых трех рядов периодической системы элементов, можно показать диаграмму, изображенную на рисунке 51, на которой хорошо видно периодическое изменение валентности у всех элементов, если их расположить в порядке возрастания атомных масс. На основе этого учащиеся могут сделать правильные заключения о том, что валентность в ряду элементов, расположенных в порядке возрастания атомной массы, изменяется периодически, но величина периодов не одинакова (одни короче, другие длиннее).
Теперь можно сформулировать вывод, что валентность химических элементов находится в периодической зависимости от величины их атомных масс. Сравнивая другие свойства химических элементов, можно обратить внимание учащихся на периодическое ослабление и усиление металлических и неметаллических свойств. При этом нужно ограничиться лишь общим обзором: отметить физическое состояние, блеск, электропроводность элементов первых периодов. На основе этих сравнений делают вывод о том, что металлические признаки элементов усиливаются или ослабляются периодически в зависимости от величины атомных масс элементов. Из химических свойств следует сравнить химическую активность элементов в отношении их к водороду и к кислороду. И в этом случае нужно сравнивать не все элементы, а выборочно и по преимуществу изученные в школе. После такой работы учащиеся могут сделать обобщение: свойства простых веществ находятся в периодической зависимости от величины атомных масс элементов. При этом важно напомнить учащимся, что это относится не к отдельным элементам, а к ряду элементов. Затем можно сравнить состав, свойства окислов и гидратов окислов элементов второго и третьего периодов, отметить ослабление основных и. усиление кислотных свойств окислов и гидратов окислов элементов в каждом ряду по мере увеличения атомных масс этих элементов. На основании таких сравнений учащиеся должны прийти к выводу, что химические свойства элементов, состав и свойства окислов и гидратов окислов элементов тоже находятся в периодической зависимости от величины атомных масс элементов.
Обобщая все это, можно дать такую формулировку периодическому закону, какую дал Д. И. Менделеев, а затем сформулировать закон в сокращенном виде. Свойства химических элементов находятся в периодической зависимости от величины их атомных масс.
Нужно проверить, правильно ли понимают учащиеся выражение "зависят от величины атомных масс элементов". Относят ли они это выражение к отдельному элементу или к ряду элементов, расположенных в порядке возрастания их атомных масс.
Периодическая система. После вывода периодического закона следует приступить к коллективному составлению таблицы, выражающей периодическую систему. В педагогической практике применяется несколько вариантов решения этой методической задачи: отдельные карточки со знаками химических элементов развешиваются на бечевках, протянутых на классной доске, или учащиеся раскладывают на своих столах заготовленные ими листочки бумажек с названиями химических элементов и краткой характеристикой их; можно перед уроком вывесить в классе бумажную ленту, на которой написаны (или наклеены) знаки химических элементов и их атомные массы, или воспользоваться приемом фланелеграфии. Для этого надо на доске закрепить полотно из фланели (байки). На полотно наложить в определенной последовательности карточки (с химическими символами и атомными массами), на обратной стороне которых наклеена марля. Шероховатая поверхность марли хорошо сцепляется с тончайшими ворсинками фланели, и поэтому карточки прочно удерживаются на этом полотне.
В начале урока ставится учебная задача: научить учащихся классифицировать химические элементы на основе периодического закона. С этой целью учитель предлагает рассмотреть ряд химических элементов, выявить сходные и расположить их друг под другом. В соответствии с этим учитель выделяет сначала знаки водорода и гелия, а затем элементы двух малых периодов (второй и третий) и прикладывает знаки элементов этих периодов так, чтобы названия сходных элементов располагались друг под другом.
В таком виде таблица отражает достаточно точно периодический закон Д. И. Менделеева, но неудобна в обращении. Чтобы сделать ее компактной, преподаватель разделяет элементы на две части, каждую из них помещает друг под другом так, чтобы начла и концы периодов совпадали.
Следует отметить, что изучение свойств химических элементов подтверждает правильность деления больших периодов на четные и нечетные ряды, так как элементы главной подгруппы в какой-то мере сходны с элементами побочной подгруппы одной и той же группы. Свойства элементов в побочных подгруппах тоже закономерно изменяются в зависимости от атомных масс. Таким образом, будет дано правильное понятие о четных и нечетных рядах как о проявлении закономерности, существующей в природе, а не придуманной человеком, хотя бы и для удобства составления таблицы.
При такой совместной работе учащихся с учителем достигается большая ясность в понимании не только принципа составления периодической системы, но и некоторых ее деталей. Например, учащиеся поймут, почему медь находится в первой группе, хотя она и не обладает свойствами щелочных металлов, а марганец находится в одной группе с галогенами, почему знаки элементов четных и нечетных рядов сдвинуты влево или вправо. В результате такого предварительного изучения периодической системы учащиеся должны понять, что в каждой клетке ее должен быть элемент с определенными свойствами и атомной массой. Эти константы можно довольно точно предсказать, если известны свойства и атомные массы элементов, занимающих соседние места в периодической системе. Для закрепления этих знаний следует предложить учащимся рассказать о свойствах какого-либо элемента третьего ряда, закрыв в таблице знак и название этого элемента. Можно рекомендовать программированный метод совершенствования знаний. Например, чтобы написать формулу соли кислородной кислоты - марганцовокислого бария (Mn № 25, Ва № 56), учитель разрабатывает алгоритмы конкретных действий: 1. Находят валентность металла (бария) по таблице. 2. Находят формулу марганцовой кислоты, поскольку марганцовокислый барий - ее соль (НMnО4). 3. Составляют формулу марганцовокислого бария Ba(MnО4)2. Сильные учащиеся справляются быстро е заданием и получают дополнительные упражнения. В конце работы все выполняют контрольную работу. Ее можно дать не только в виде вопросов, но и выборочно. Например, на предложенный вопрос дат несколько ответов, из которых надо выбрать правильные:
1. Укажите элементы с ярко выраженными неметаллическими свойствами: хлор (№ 17), сурьма (№ 51), кислород (№ 8), германий (№ 32), ниобий (№ 41).
2. Какие из перечисленных элементов находятся в малых периодах: скандий (№ 21), кислород (№ 8), кальций (№ 20), марганец (№ 25), азот (№ 7)?
3. Какой из перечисленных элементов имеет окисел состава Э2О5: хром (№ 24), цирконий (№ 40), фосфор (№ 15), ртуть № 80), гафний (№ 72)?
4. Какие из перечисленных элементов имеют гидроокиси состава ЗОН: молибден (№ 42), серебро (№ 47), бром (№ 35) рубидий (№ 37), литий (№ 3)?
5. Какой из перечисленных элементов проявляет валентность по водороду, равную четырем: углерод (№ 6), индий (№ 49), тантал (№ 73), титан (№ 22), таллий (№ 81)?
История открытия периодического закона и создание периодической системы. Ознакомление учащихся с историей открытия периодического закона имеет целью показать, что великие открытия - это не случайные удачи людей, а результат многолетнего труда ученых и практических, работников.
У каждого ученого, сделавшего крупные открытия, были свои предшественники. Это нисколько не умаляет значения роли отдельного ученого, совершившего большое открытие, что можно показать, сравнивая догадки Деберейнера и Ньюлэндса с научными работами Д. И. Менделеева.
Сообщая об открытии Деберейнером триад как о первой догадке существования связи между атомными массами и другими свойствами химических элементов, следует указать на отсутствие каких-либо, обобщении в работе этого ученого. Он подметил несколько фактов, описал их, но теоретически не обосновал, ... Несколько дальше пошел Ньюлэндс. Но при более внимательном ознакомлении с его таблицей обнаруживается поверхностное и даже легкомысленное отношение к научным гипотезам.
После краткого ознакомления с предположениями этих ученых нужно сообщить учащимся, что Д. И. Менделеев не знал об этих работах до опубликования своего открытия. В этом нетрудно убедиться, если прочитать дополнение к XV главе его учебника "Основы химии", где приводится много источников, которыми пользовался Д. И. Менделеев в своих исследованиях. Особо следует остановиться на необоснованных претензиях некоторых немецких ученых, которые пытались приписать приоритет в открытии периодического закона Л. Мейеру. Необходимость в разъяснении учащимся необоснованности этих претензий, вызвана тем, что в некоторых иностранных учебниках химии периодический закон называется законом Л. Мейера и Д. И. Менделеева. Но Д. И. Менделеев писал: "Что же касается исследований профессора Лотара Мейера, касающихся периодического закона, то, судя по самому способу изложения первой его статьи (Sieb. Ann. Suppe, VII, 1870, 364), в самом начале которой цитирован реферат вышеназванного мною исследования 1869 г., очевидно, что периодический закон был взят им в том виде, как он дан мною"*.
* (Д. И. Менделеев. Основы химии, изд. 13, т. II. Государственное научно-техническое издательство химической литературы, 1947, стр. 382.)
Неосновательность претензий Л. Мейера на приоритет в открытии периодического закона можно увидеть из сравнения его таблицы элементов с первой таблицей Д. И. Менделеева. Прежде всего таблица Л. Мейера содержит лишь 27 элементов из 63 известных в то время. Очевидно, остальные не укладывались в "придуманную" Л. Мейером схему. Он считал ее только "удобным наглядным пособием" для преподавания химии и не пытался делать из нее каких-либо обобщений, которые могли бы затем служить руководством в научно-исследовательской работе. Более того, он не соглашался с Д. И. Менделеевым, который на основе своей системы указывал ошибки в определении атомных масс некоторых элементов и предлагал их исправить. Л. Мейер считал теоретические исследования Д. И. Менделеева недостаточными для того, чтобы исправлять эти ошибки. Совершенно иначе оценивал свое открытие Д. И. Менделеев: он видел в нем важнейший закон природы, знание которого позволяет уточнить данные об открытых элементах, предугадывать существование некоторых еще неизвестных элементов.
Следует обратить внимание учащихся на то, что в периодической таблице (1869 г.) находилось всего лишь 63 элемента, и около чисел, обозначающих атомные массы некоторых элементов, поставлены были знаки вопроса, показывающие сомнения Д. И. Менделеева в правильности написанных чисел. И все же он нашел возможным заявить о существовании в природе периодического закона, который, будучи положен в основу систематики элементов, превратился в теоретическое руководство. Эту уверенность следует рассматривать не только как результат его обширных познаний в области химии, но и как следствие правильного понимания значения теории в развитии науки. Знакомить учащихся с историей открытия периодического закона надо после изучения его, так как только при этих условиях учащиеся могут правильно оценить открытие Д. И. Менделеева.
Краткая биография Д. И. Менделеева. О Д. И. Менделееве написано много книг, большинство которых доступно пониманию учащихся VIII класса. Это облегчает ознакомление их с жизнью и деятельностью ученого. Но нужно не просто сообщить биографические данные о замечательном ученом и талантливом человеке, а показать пример, достойный подражания: большую трудоспособность Д. И. Менделеева, самоотверженность и энтузиазм в работе, горячую любовь к своей родине и своему народу. Ознакомление с научной и общественной деятельностью Д. И. Менделеева должно воодушевить учащихся, укрепить в них веру в творческие силы нашего народа и собственные силы. Имея в виду эти воспитательные задачи, нужно отобрать надлежащий биографический материал и соответствующим образом изложить его. Говоря о детских годах Д. И, Менделеева, следует хотя бы в общих чертах обрисовать обстановку, в которой он находился, Следует также отметить, что в семье Менделеевых были желанными гостями ссыльные декабристы. Это, несомненно, создавало определенную политическую атмосферу, содействовало формированию смелого, независимого характера.
На занятиях Д. И. Менделеева в гимназии и в педагогическом институте можно подробно не останавливаться, ограничиться лишь замечанием, что в институте он увлекался занятиями по химии, не переставая интересоваться и другими науками (посещал лекции и изучал дисциплины историко-филологического факультета). Благодаря этому Д. И. Менделеев поражал своих товарищей по институту широтой общего научного кругозора и особенно в области физики и химии.
Можно также остановиться на заграничной научной командировке Д. И. Менделеева (чтобы отметить условия, в которых он должен был вести научную работу), охарактеризовать эмпирическое направление в науке того времени. На фоне эмпиризма в науке и низкого уровня теоретических работ в научных лабораториях немецкого "прославленного" университета надо показать крупную фигуру молодого русского ученого, приехавшего за границу с готовым мировоззрением, определенной темой, работа над которой должна была открыть автору пути решения важнейших проблем в области, как он говорил, "механики атомов и молекул". В этом Д. И. Менделеев видел ключ к пониманию и овладению химическими процессами. Нетрудно видеть, что в этой области он был продолжателем работ своего великого соотечественника М. В. Ломоносова и подобно ему стоял уже в начале своей научной деятельности выше многих своих западных коллег и учителей. В качестве примера можно рассказать о съезде химиков в Карлсруэ, где было установлено различие между понятиями атома и молекулы и указаны способы определения атомных и молекулярных масс. Если учащиеся осознали основное направление в работе Д. И. Менделеева, то они должны понять причины особого интереса у него к этим вопросам: с понятием об атомном весе он связывал понятие о массе атома, от которой, по его мнению, зависят все свойства элементов.
Для характеристики научно-педагогической деятельности Д. И. Менделеева следует рассказать о том, что он читал лекции сначала по органической, а затем по неорганической химии и написал в исключительно короткий срок учебник по органической химии, который затем был удостоен премии как лучший. Еще более замечателен его труд "Основы химии". Он изучил все лучшее и ценное, что было напечатано в то время в России и Западной Европе, и создал совсем новое, непохожее на то, что было сделано до него. Нужно обратить внимание учащихся на то огромное количество фактов, которые были нагромождены в учебниках и научных трудах предшественников Д. И. Менделеева, тогда учащиеся более правильно оценят научный подвиг его.
Сообщая об открытии периодического закона, нужно избегать чрезмерных упрощений, которые допускаются иногда на практике. Некоторые учителя выдвигают на первый план карточки с написанными на них обозначениями элементов и их атомными массами. У учащихся может сложиться представление об открытии периодического закона как о счастливом случае, выпавшем неожиданно на долю Д. И. Менделеева. Процесс к раскладывания карточек с названиями элементов нужно представить как заключительный этап огромной предварительной научной работы по изучению фактов, которыми руководствовался в своих работах Д. И. Менделеев.
Большое впечатление на учащихся производит предсказание Д. И. Менделеевым неоткрытых элементов. Между предсказанием и открытием прошло около 15 лет, в течение которых ученый мир того времени уже знал об открытии периодического закона, но никто по достоинству не оценил его. Большинство ученых относились к нему сдержанно и недоверчиво. После же открытия трех элементов, предсказанных Д. И. Менделеевым, и исправления атомных масс некоторых элементов резко изменилось отношение к периодическому закону.
Чтобы дать учащимся некоторое представление о том, как высок был научный авторитет Д. И. Менделеева в ученом мире Западной Европы, следует рассказать о приглашении его английскими учеными для чтения лекций в Лондонском королевском институте. Еще более почетным было второе приглашение - Английским химическим обществом для так называемых "фарадеевских чтений". Такие чтения происходили редко (раз в несколько лет) по поводу каких-либо исключительных открытий. За все полувековое существование этого общества лишь четырех ученых удостоили этой чести и в том числе Д. И. Менделеева. Нужно также указать на избрание Д. И. Менделеева почетным членом почти всех академий наук Западной Европы, многих научных обществ. Полный ученый титул Д. И. Менделеева состоял более чем из 100 названий. На этом фоне почета и признания научных заслуг следует показать отношение к нему Петербургской академии наук.
Можно снова напомнить и о той борьбе, которую вел М. В. Ломоносов с немецким засильем в Академии наук. Эта борьба не окончилась к тому времени, когда Д. И. Менделеев должен был быть избран в Академию в качестве действительного члена. Ни научные заслуги, ни мировая слава не сказали достаточного воздействия на руководство Академии и многих ее членов: кандидатура Д. И. Менделеева была отклонена.
Следует отметить существенное различие в обстановке, в которой вели борьбу М. В. Ломоносов и Д. И. Менделеев: первый был одинок в ученом мире, у второго было много друзей, имена которых как ученых известны за пределами России.
Для иллюстрации можно зачитать выдержку из опубликованного в печати протеста ученых, членов физико-математического факультета Московского университета против решения Академии: "... но пора сказать прямое слово, пора назвать недостойное недостойным. Во имя науки, во имя народного чувства, во имя справедливости мы считаем долгом выразить наше осуждение действию, несовместимому с достоинством ученой корпорации и оскорбительному для русского общества"*.
* (Цит. по кн.: Б. Г. Кузнецов. Ломоносов, Менделеев, Лобачевский. М., Изд-во, АН СССР, 1945, стр. 226-227.)
В качестве протеста русские ученые объявили подписку на учреждение стипендии имени Д. И. Менделеева. Много писем и телеграмм получал Д. И. Менделеев с выражением протеста против решения Академии. Следует прочитать ответ его на эти письма и телеграммы: "Понимаю, что дело идет об имени русском, а не обо мне. Посеянное на поле научном взойдет на пользу народную"*.
* (Д. И. Менделеев. Литературное наследство. Изд-во, ЛГУ, 1937, стр. 7.)
В связи с этим необходимо напомнить учащимся об отношении Советского правительства к ученым, об учреждении академий, научно-исследовательских институтов; отметить заботу о быте ученых. Такое сравнение дает хороший воспитательный эффект.
Давая характеристику научной деятельности Д. И. Менделеева, следует познакомить учащихся в общих чертах и с другими его научными работами: теорией растворов, основы которой признаются справедливыми и теперь; изобретением бездымного пороха; по добыче и переработке нефти; по использованию каменного угля; подземной газификации и др. Все это должно привести к формированию представлений у учащихся о Д. И. Менделееве как ученом с широким научным диапазоном. Оценивая Д. И. Менделеева как общественного деятеля, необходимо отметить глубокий его патриотизм, любовь к русскому народу, заботу о его благосостоянии.
В завещании своим детям Д. И. Менделеев советует трудиться без расчетов на личные выгоды: "...жить надо для близких, расширяя круг близости по возможности... Одно знаю, что, живя про себя, собой и мыслью своей, - скука, тяжко, а живя сам собой и всеобщей жизнью... можно найти покой и радость"*. Нужно отметить, что не на словах, а всей своей деятельностью он показал пример честного, бескорыстного служения на благо всего человечества, заботясь в первую очередь о счастье русского народа.
* (Цит. по кн.: Б. Г. Кузнецов. Ломоносов, Менделеев, Лобачевский. М., Изд-во АН СССР, 1945, стр. 324.)
Значение периодической системы. О научном значении, периодической системы учащиеся должны узнать не только со слов учителя, но и из опыта своей учебной работы по химии.
В заключительной беседе по этой теме необходимо напомнить им следующее:
1. В основу классификации Д. И. Менделеев положил массу атома и свойства элементов.
2. Периодическая система отражает порядок, существующий в природе, а не является только наглядным пособием, придуманным для облегчения преподавания химии.
3. Периодическая система позволяет сравнительно просто объяснить и предвидеть свойства открытых элементов и даже еще не открытых элементов.
Изучая периодическую систему, учащиеся знакомятся с химическим элементом. Хотя Д. И. Менделеев не формулировал определения химического элемента на основе открытого им закона, но из всех его высказываний следует, что он считал элементом вид атомов, занимающий определенное место в периодической системе. Тем самым у учащихся расширяется понятие о химическом элементе, так как вскрываются его связи с другими элементами. Следует отметить, что некоторые элементы стоят в ней не в порядке возрастания атомного веса (йод и теллур, аргон и калий, никель и кобальт). Д. И. Менделеев допускал вначале возможность ошибки в определении атомных весов этих элементов. Но тщательная проверка показала правильность этих определений. Причина этого отступления была выяснена значительно позже.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'