
Строение атомов элементов больших периодов
В программе школьного курса химии долгое время не рассматривали строение атомов больших периодов, хотя некоторые элементы этих периодов (железо) подробно изучают в школе. Учитель химии чаще всего останавливается на строении атома железа, совершенно не затрагивая строения атомов элементов побочных подгрупп, в результате чего у учащихся может создаться неправильное представление, будто на внешнем слое атомов элементов находится число электронов, равное номеру группы. Все это побуждает учителей химии сообщать учащимся элементарные сведения о строении атомов элементов больших периодов.
В настоящее время нельзя ограничиться в средней школе изучением строения атома только на основе планетарной теории движения электрона, так как учащиеся читают научно-популярную литературу, в которой излагаются более современные воззрения на строение атома.
При изучении строения атомов малых периодов учитель рассказывает не только о том, что электроны движутся вокруг ядра, но и о том, что они вращаются вокруг собственной оси. Так дается понятие о спине электрона (слово "спин" в переводе с английского означает веретено), а так как электрон заряжен отрицательно, то его вращение вокруг оси приводит к возникновению магнитного момента. В атомах спины электронов ориентированы в двух противоположных направлениях. Так, в атоме водорода спин электрона можно обозначить условно стрелкой ↑, а в атоме гелия два электрона имеют противоположные спины, что условно изображают так: ↑↓. Такие два электрона с противоположно направленными спинами называют спаренными, они-то и дают прочную конфигурацию, поэтому не случайно гелий является инертным газом, не вступающим в химические реакции, так как надо затратить много энергии, чтобы оторвать от его ядра два спаренных электрона.
При изучении атомов других химических элементов следует сказать, что хотя электроны распределены по определенным энергетическим уровням, но на каждом из этих уровней не все электроны обладают одинаковым запасом энергии, т. е. вводится понятие о том, что электроны находятся на различных энергетических подуровнях. На каждом электронном уровне имеется s-подуровень, где электроны находятся вокруг ядра в пространстве сферической формы (5 - начальная буква слова "сферический"). Электроны, находящиеся на этом подуровне, называют s-электронами. На втором и других энергетических уровнях, кроме s-электронов, имеются p-электроны, распределенные на p-подуровне. Эти электроны распределяются на этом подуровне в виде гантели или восьмерки, где в центре находится ядро, а орбита состоит как бы из двух взаимно перпендикулярных частей (отсюда и название этого подуровня, р - начальная буква слова "перпендикуляр"). Есть энергетические подуровни d и f, где электроны движутся по еще более сложным орбитам. На основе этих представлений учащимся можно дать понятие об электронных формулах атомов на простейших примерах: Н-1s1; He-1s2; Li-ls2s1; С-ls22s2p2; О-ls22s22p4. Перед буквой поставлен номер электронного слоя, буква означает электронный подуровень, а показатель степени - число электронов в данном подуровне. Так, электронная формула для лития читается так: атом лития имеет два энергетических уровня, на первом уровне находятся два s-электрона, на втором - один s-электрон. Электронная формула для атома углерода: в атоме углерода имеется два энергетических уровня. На первом уровне движутся два s-электрона, на втором - два s-электрона и два s-электрона.
При энергетической оценке электронов надо учитывать то, что на одном и том же энергетическом уровне запас энергии увеличивается в следующей последовательности: s→p→d→f, т. е. самый низкий запас энергии имеется у s-электронов, и труднее оторвать от ядра s-электроны, чем, например, p-электроны. Это надо иметь в виду при изучении валентности, в образовании которой принимают участие s- и p-электроны. Какое максимальное число электронов содержится в третьем, четвертом и других слоях? Для этого надо знать следующую закономерность: наибольшее количество электронов, которое может содержаться в электронном слое, равно удвоенному квадрату номера слоя 2n2, где n - номер слоя. На внешнем слое не может находиться более восьми электронов, предпоследний электронный слой содержит не более восемнадцати электронов. Число внешних электронов у атомов элементов главных подгрупп совпадает с номером группы, а у атомов побочных подгрупп, в которые входят только металлы, на внешнем слое, как правило, находится два электрона (исключение: атомы элементов побочной подгруппы первой группы - хром, молибден, и радий, на внешнем слое имеют по одному электрону).
Последовательность заполнения схемы распределения электронных слоев следующая (дан пример строения атома ртути):
1. Находят порядковый номер, указывающий на общее число электронов (порядковый номер ртути - 80).
2. Выписывают номер периода. Он указывает на число электронных слоев (ртуть находится в VI периоде - в атоме ртути имеется шесть электронных слоев).
3. Отмечают номер группы и подгруппы (ртуть расположена во второй группе побочной подгруппы - на внешнем слое атома находится два электрона).
4. Распределяют электроны по слоям:
а) заполняют два первых слоя от ядра (2, 8);
б) пишут число электронов на внешнем слое (2);
в) заполняют 3-й, 4-й и другие слои, исходя из формулы 2n2 (2, 8, 18, 32);
г) из общего числа электронов атома вычитают полученную сумму электронов и таким путем находят число электронов на предпоследнем слое (для ртути: 80-62=18).
После этого учащиеся выполняют самостоятельно упражнения, например: составить схемы строения атомов цинка, кадмия, вольфрама (табл. 16).

Таблица 16
На основе изучения строения атомов элементов больших периодов учащиеся расширяют свои понятия о валентности и химической связи, они узнают, что валентными могут быть электроны не только внешнего слоя.
Соединение атомов в молекулы. Программой по химии предусмотрено ознакомление учащихся с двумя видами химической связи: ионной и ковалентной.
Для ознакомления с ионной связью можно сначала рассмотреть знакомую учащимся реакцию соединения натрия с хлором. Заряды ионов натрия и хлора сопоставляются с валентностью этих элементов в данном соединении. Рассматривая строение кристаллов хлорида натрия, хлорида калия и др., следует обратить внимание учащихся на то, что эти кристаллы состоят не из молекул, а из ионов (рис. 55). Можно сказать, что в кристаллах солей находятся ионы металлов и кислотных остатков, которые взаимно удерживаются и образуют определенную кристаллическую решетку. В качестве наглядного пособия рекомендуется использовать модель кристаллической решетки хлорида натрия. Это пособие могут изготовить учащиеся, пользуясь пластилином и железными спицами.
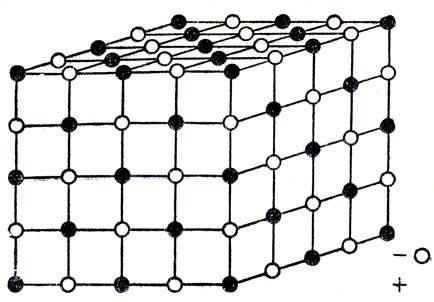
Рис. 55. Кристаллическая решетка хлорида натрия
Сопоставляя схемы строения ионов натрия и хлора со схемами строения неона и аргона, учитель обращает внимание на сходство наружных электронных сфер у ионов и атомов инертных газов. Из этого сравнения следует вывод, что в процессе химического взаимодействия атомы и ионы как бы стремятся к тому, чтобы их внешняя электронная оболочка была сходна с электронной оболочкой инертных газов. Сравнивая схемы строения атомов щелочных металлов и галогенов, можно показать, что у атомов металлов образуется внешняя восьмиэлектронная оболочка отщеплением наружных электронов, а у атомов неметаллов - присоединением дополнительных электронов, что приводит к образованию в первом случае положительно заряженных, во втором - отрицательно заряженных ионов.
Можно показать опыты, подтверждающие переход электронов от атомов металлов к атомам неметаллов. Наиболее простым является следующий опыт: электроды от прибора для обнаружения электропроводности веществ вставляют в кусок натрия, прибор включают в электросеть - лампочка загорается. Учащиеся знают из курса физики, что электропроводность металлов объясняется наличием в них свободных электронов. При изучении галогенов учащиеся видели опыт непосредственного взаимодействия натрия с хлором и образования при этом кристаллов хлорида натрия. Теперь переносят электроды прибора для обнаружения электропроводности на кристаллы поваренной соли и наблюдают, что лампочка не горит. Почему это происходит, куда же делись электроны, находившиеся в металле? На основе этого опыта учитель и делает заключение о переходе электронов от атомов натрия к атомам хлора и об образовании соответствующих ионов.
Можно продемонстрировать еще более яркий опыт, показывающий переход электронов от металлов к неметаллам и образование ионной связи (рис. 56). Между загнутыми электродами прибора для обнаружения электропроводности (зазор величиной около 1 мм) кладут ленту или стружку магния. Включают прибор в электросеть. Лампочка горит ярко. Поджигают магний, он превращается в белую окись магния - и лампочка гаснет. Учитель объясняет наблюдаемое явление.
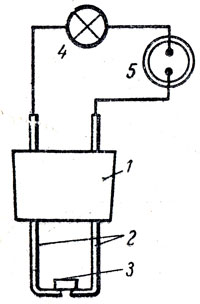
Рис. 56. Горение магния на электродах: 1 - пробка для закрепления электродов, 2 - электроды, 3 - магний, 4 - электрическая лампочка, 5 - розетка
Для ознакомления учащихся с ковалентной связью следует вначале рассмотреть случаи образования неполярных (гомеополярных) молекул водорода, фтора, хлора, метана и др. Чтобы учащиеся убедились в том, что действительно при различных химических процессах образуются атомы, которые существуют очень непродолжительное время и объединяются в молекулы, проделывают следующий опыт, который основан на восстановлении меди из ее окиси при помощи водорода. Учащимся известно, что эта реакция начинается при сильном нагревании, атомный же водород восстанавливает окись меди до меди при комнатной температуре. Для опыта в пробирку кладут 2-3 кусочка цинка, кусочек гранулированной окиси меди и наливают 5-6 мл раствора серной кислоты (1:5), сверху пробирку закрывают бумагой, в которую завертывают окись меди. Через несколько секунд под действием атомного водорода кусочек окиси меди краснеет, превращаясь в закись меди, а окись меди вверху остается без изменения, что указывает на то, что молекулярный водород при этих условиях не восстанавливает медь из ее окиси.
Экспериментальная проверка показала, что лучшие результаты получаются при помощи лабораторной работы, проведенной исследовательским методом. При этом учащиеся сами проделывают опыты и активно участвуют в обсуждении их результатов. Учитель далее сообщает, что, кроме молекул гомеополярных и ионных, возможны и такие случаи, когда электроны лишь смещаются в сторону одного из атомов, образуя молекулы, в которых положительные заряды смещены в одну сторону, а отрицательные - в другую.
Обычно учащиеся хорошо усваивают ионную связь, но хуже - ковалентную связь. Для уяснения различий между ионной и ковалентной связью, а также промежуточной полярной связью можно показать схему (рис. 57), где все виды связи сопоставляются и сравниваются. Следует ли раскрывать механизм ковалентных связей? В средней школе это сделать полностью невозможно, но надо познакомить учащихся еще с одним видом движения электронов. Они движутся не только вокруг ядра, но и вокруг своей оси. Это вращение называется спин: Спин у электронов неодинаковый: одни электроны вращаются по часовой стрелке, другие - против. При этом они образуют электромагнитное поле. А так как при вращении электронов с различными спинами возникают электромагнитные силы, противоположные по направлению (подобно разноименным магнитам), то эти пары, электронов, принадлежащие различным атомам, прочно объединяют их в молекулы. Надо указать учащимся, что при образовании ковалентной связи выделяется значительное количество энергии. Поэтому молекулы с ковалентной связью должны быть прочными. При образовании 1 моля следующих веществ выделяется определенное количество энергии: H2 - 104 ккал, О2 - 118 ккал, N2 - 225 ккал, HF - 136 ккал. Следует сообщить также, что при образовании молекул с ковалентной связью возникают спаренные электроны с противоположными спинами, что объединяет их в прочную молекулу. Это схематично можно показать так:
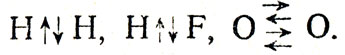
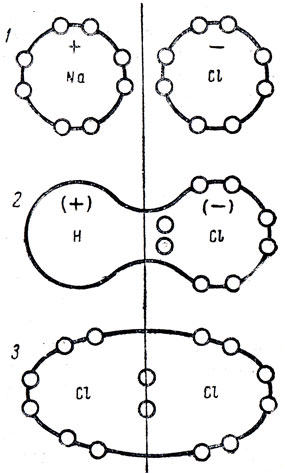
Рис. 57. Схема строения молекул с различной химической связью: 1 - молекулы с ионной связью, 2 - полярные молекулы, 3 - неполярные молекулы
В X классе при изучении органической химии учащихся знакомят с σ- и π-связями. Учитель рассказывает о том, что ковалентная связь осуществляется за счет перекрывания электронных облаков, причем это происходит следующим образом:
1. При образовании молекул перекрываются электронные облака по линиям связи, соединяющей центры двух атомов. Так образуется σ-(сигма), связь, здесь могут перекрываться электронные облака двух s-s-электронов (рис. 58, а), двух s-p-электронов или p-p-электронов (рис. 58, б).
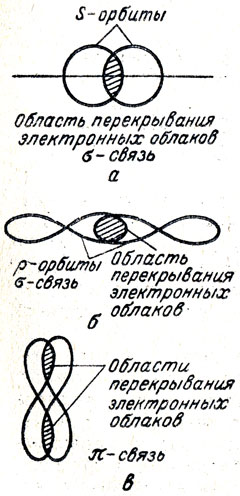
Рис. 58. σ- и π-связи
2. Электронные облака электронов могут пересекаться перпендикулярно линии, соединяющей ядра атомов. Так образуется π-связь (рис. 58, в). Она менее прочна, чем σ-связь, так как, несмотря на двукратное перекрытие, площадь его меньше, чем при σ-связи. При двойной и тройной связи только одна из них бывает σ-связью. Это важно знать при изучении непредельных углеводородов; при реакции присоединения в их молекулах в первую очередь разрываются π-связи и остается более прочная σ-связь. Для объяснения σ- и π-связи можно воспользоваться детскими шарами (круглыми и продолговатыми). Один круглый шар схематически отображает s-электрон, а два связанных продолговатых шара - p-электрон (объемную гантель). Складывая два надутых круглых шара или круглый и продолговатый шар, показывают образование σ-связи, если же сложить два связанных продолговатых шара с двумя подобными шарами, то можно показать возникновение π-связи.
Ввиду важности и распространенности комплексных соединений учащихся следует познакомить с координационной связью как особым видом ковалентной связи. Это можно осуществить на примере образования иона аммония. При получении аммиака из азота и водорода остается свободная пара электронов у атомов азота (ее называют неподеленной). При взаимодействии молекул аммиака и ионов водорода (у иона водорода нет электронов) за счет неподеленной пары электронов атома азота образуется химическая связь:
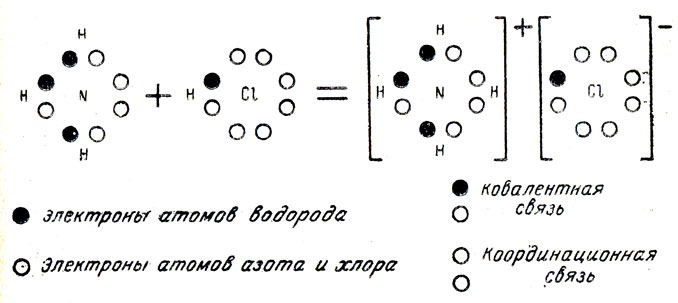
Как видно, ковалентная связь образуется за счет возникновения электронных пар, отданных от каждого атома ( ). При образовании координационной связи также образуется электронная пара, но за счет обобществления неподеленного электрона - электронная пара азота в молекуле аммиака (
). При образовании координационной связи также образуется электронная пара, но за счет обобществления неподеленного электрона - электронная пара азота в молекуле аммиака ( ) - и другого атома или иона, у которого недостает электронной пары, - ион водорода.
) - и другого атома или иона, у которого недостает электронной пары, - ион водорода.
В связи с изучением координационной связи учащимся дают понятие о комплексных соединениях как о таких сложных соединениях, образование которых из более простых веществ не связано с возникновением новых электронных пар. В качестве примеров рассматриваются вещества, хорошо известные учащимся или такие, знание которых необходимо для дальнейшего изучения курса неорганической и органической химии, например при подливании к раствору медного купороса образуется ярко-синий раствор комплексного соединения [Сu(NH3)4]SO4. При изучении органической химии учащиеся проделывают реакцию серебряного зеркала, для этого к раствору нитрата серебра добавляют водный раствор аммиака. В школе его называют аммиачным раствором окиси серебра. Теперь учитель может сказать, что здесь образовалось комплексное соединение.
Для ориентировки учащихся при определении вида химических связей в том или ином веществе можно сообщить им, что многие твердые вещества состоят из ионов, газообразные же состоят из молекул, в которых атомы удерживаются ковалентной связью.
Валентность. Окислительно-восстановительные реакции. В связи с ознакомлением учащихся с различными видами химической связи следует пересмотреть в свете электронной теории понятие о валентности.
После беседы на эту тему можно сделать обобщение: 1) в соединениях с ионной связью валентность элементов равна числу электронов, перешедших от одного атома к другому; 2) в соединениях с ковалентной связью валентность элементов равна числу пар электронов, которые являются общими для двух или более атомов; 3) число электронов, которые могут перейти от атома какого-либо элемента, не превышает номера группы периодической системы, в которой находится этот элемент; 4) число электронов, которые могут быть присоединены к атому, не превышает разности между числом 8 и числом, показывающим номер группы, в которой находится элемент.
В заключение следует пересмотреть понятия "окисление" и "восстановление" в свете электронной теории. С этой целью нужно но рассмотреть некоторые реакции соединения одного и того же металла с различными неметаллами. Для начала можно ограничиться такими реакциями, в результате которых получаются вещества, имеющие ионные связи. Например, разобрать на основе электронной теории взаимодействие натрия с хлором, с серой, с кислородом, взаимодействие хлора с кальцием, с железом, с хлоридом железа,
Сравнивая механизм этих реакций с реакцией соединения натрия с кислородом, учащиеся найдут, что общим для всех реакций является перемещение электронов от одного атома к другому или от атома к иону, что приводит к изменению валентности элементов.
При рассмотрении других реакций, например взаимодействия натрия с хлором, серой и др., учащиеся убеждаются в том, что поток электронов возникает не только при взаимодействии металлов с кислородом, но и с другими элементами, и, следовательно, все реакции, сопровождающиеся отдачей и приемом электронов, относятся к окислительно-восстановительным.
На простейших примерах можно показать электронный баланс при окислительно-восстановительных реакциях и расстановку на основе этого коэффициентов, например:
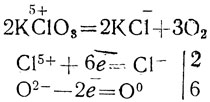
Коэффициенты ставят на основе того, что число отданных электронов равняется числу принятых. Таким образом, учащиеся приходят к более глубокому пониманию окислительно-восстановительной реакции и вместе с тем убеждаются, что электронная теория позволяет обобщить некоторые явления. Рассматривая понятие о валентности на основе электронной теории, следует иметь в виду, что к этому вопросу нужно еще возвратиться при изучении теории электролитической диссоциации. Поэтому данный урок не следует перегружать примерами, которые более уместно рассматривать позже.
Ядерные реакции. Предыдущие занятия можно рассматривать как применение вновь изученной электронной теории к объяснению химических реакций.
После этого следует показать, как электронная теория объясняет радиоактивные явления. Для этого учащиеся должны ознакомиться с составом атомных ядер и расширить круг своих знаний о свойствах атомов, ознакомиться с некоторыми ядерными реакциями. Урок на эту тему можно начать с краткого повторения того, что учащиеся узнали о радиоактивных явлениях на первых занятиях по данной теме. Они теперь знают, что представляют собой α- и β-лучи. Учитель обращает их внимание и на то, что в результате радиоактивного излучения радия получаются гелий и радон (превращение этого элемента в другие), что не наблюдается в тех случаях, когда происходят изменения в наружной электронной оболочке атома. Отсюда следует вывод, что при радиоактивных процессах происходят глубокие изменения в составе атомного ядра. Поэтому для понимания этих явлений нужно знать состав атомных ядер. Нельзя сделать вывод лишь из того, что если при радиоактивном распаде атома радия выделяются ядра гелия и электроны, то эти частицы находятся в ядре. Когда изучают состав сложного вещества, то пользуются и разложением и синтезом. Чтобы изучить состав атомных ядер, нужно получить их искусственно. Эти реакции в настоящее время осуществляются в научных лабораториях и на атомных станциях. Можно кратко рассказать об опыте Резерфорда и привести другие примеры искусственных превращений элементов, сообщить об открытии нейтрона и кратко изложить нейтронно-протонную теорию строения атомного ядра. Следует также отметить заслуги супругов Жолио-Кюри в разработке теории и способов получения искусственных радиоактивных элементов. После этого надо возвратиться к Схемам строения атомов элементов первых трех периодов системы Д. И. Менделеева и надписать массовые числа, количества протонов и нейтронов в ядрах атомов этих элементов. А затем можно рассмотреть несколько ядерных реакций, осуществляемых в атомных реакторах.
Проводя с учащимися беседу об использовании энергии ядерных превращений, не следует забывать и второй научно-технической проблемы - создания искусственных химических элементов. Можно сообщить, что в настоящее время используют в медицине ряд изотопов радиоактивных веществ, получающихся в качестве побочных продуктов в производстве плутония. Можно ожидать, что со временем будут организованы производства с целью получения искусственных элементов и их соединений, подобно тому как в настоящее время построены заводы для получения кислот, солей, органических веществ и т. д. Нельзя, разумеется, обойти молчанием тот факт, что первая в мире атомная электростанция с использованием атомной энергии для мирных целей построена в нашей стране. О том, как она работает, учащиеся узнают на уроках физики.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'