
Глава III. Теория электролитической диссоциации
Значение темы в курсе химии, содержание и последовательность изложения
Исключительно плодотворной оказалась теория электролитической диссоциации в области применения ее к разработке таких проблем, как электролиз, гальванопластика и гальваностегия, изучение коррозии металлов и т. д. Все это послужило причиной быстрого и глубокого проникновения этой теории в курсы химии высшей, а затем средней школы.
При рассмотрении этой электролитической теории на первом этапе можно ограничиться ознакомлением учащихся только с основными положениями теории и применением их к объяснению процессов растворения веществ в воде и простейших химических реакций, происходящих в растворах:
1. В водных растворах кислот, оснований и солей находятся не целые молекулы этих веществ, а ионы, которые существуют в растворах самостоятельно.
2. Ионы отличаются от атомов и молекул тем, что они имеют положительные или отрицательные заряды и обладают иными свойствами, чем атомы.
3. Ионы, как и молекулы, находятся в растворе в беспорядочном движении. При пропускании электрического тока через раствор, содержащий ионы, последние движутся к электродам в соответствии с их зарядами: положительно заряженные ионы - к катоду, отрицательно заряженные ионы - к аноду.
На основе этих положений следует рассмотреть: растворение в воде кислот, оснований и солей; понятие об этих классах химических соединений; реакции замещения и обмена, происходящие в растворах.
Дальнейшее углубление этой теории должно проходить в связи с изучением последующих тем программы. При определении последовательности изложения первой части темы следует учесть ошибки методического характера, допускаемые в преподавании химии, а также и положительный опыт педагогов-новаторов. Наиболее распространенной все еще остается так называемая "фарадеевская ошибка", состоящая в том, что учащиеся считают причиной электролитической диссоциации электролитов прохождение через их раствор электрического тока.
Причина этой ошибки кроется в неудачном использовании на уроках физики и химии истории этих наук. Авторы многих учебников и преподаватели начинают изложение теории с учения М. Фарадея об электролизе. Затем они сообщают, что М. Фарадей ошибался, объясняя диссоциацию молекул в растворе действием электрического тока, и после этого излагают теорию по С. Аррениусу. Но первые впечатления, как наиболее яркие, оставляют глубокий след в сознании учащихся. Поэтому ошибочные представления часто остаются у учащихся даже и в тех случаях, когда учитель обращает их внимание на то, что диссоциация происходит под действием воды, а не электрического тока.
Второй не менее существенной ошибкой следует признать механическое понимание процесса растворения в воде: вода рассматривается как индифферентная среда, а не как химический реагент. И эта ошибка порождается тоже неудачным историческим подходом. Авторы большинства учебников химии для высшей школы предпосылают изложению теории электролитической диссоциации учение о растворах Вант-Гоффа и других ученых, последователей физических теорий растворов. Менделеевская теория растворов и ее применение к объяснению диссоциации веществ в растворах не находит еще достаточного отражения в учебной литературе.
Исторический подход в изложении теории электролитической диссоциации, принятый в учебниках для высшей школы и частично сохранившийся в учебниках для средней школы, не является безупречным. Учащиеся воспринимают устаревшие, механистические представления о растворении и растворах по С. Аррениусу, который не учитывал химических процессов, происходящих при растворении. При этом знания учащихся электронной теории не используются.
Третья ошибка заключается в том, что по традиции используется учебный эксперимент для доказательства наличия растворах ионов так, как он применялся еще до открытия строения вещества. Обычно учитель начинает с электропроводности растворов, показывая опыты с электрической лампочкой, которая загорается при опускании электродов в растворы электролитов. Этот яркий опыт настолько запечатлевается в сознании учащихся, что никакие словесные указания в дальнейшем о роли растворителя в процессе диссоциации электролитов не могут привести к правильным представлениям. Поэтому надо отказаться от демонстрации этого опыта в начале изучения этой темы и перенести его на более позднее время.
Чтобы сформировать у учащихся правильное понятие о теории электролитической диссоциации, можно предложить такую последовательность изложения темы:
1. Введение. Свойства водных и неводных растворов различных классов неорганических соединений.
2. Растворение в воде с точки зрения электронной теории.
3. Диссоциация молекул электролитов в растворе.
4. Степень электролитической диссоциации. Слабые и сильные электролиты.
5. Химические реакции в свете ионной теории.
6. Гидролиз.
7. Электролиз.
Свойства водных и неводных растворов различных классов неорганических соединений. Учащимся известно, что вещества растворяются не только в воде, но и в других растворителях. Проявляют ли различные классы неорганических соединений в водных растворах такие же свойства, как и в других растворах? Для разрешения этого вопроса проделывают лабораторные опыты:
1. В пробирку с 2-3 мл концентрированной серной кислоты опускают несколько кусочков цинка. В концентрированной серной кислоте водород почти не выделяется. Содержимое пробирки переливают в другую пробирку с водой. Сразу же начинает идти реакция с бурным выделением водорода.
2. В пробирку наливают около 1 мл концентрированной уксусной кислоты и 10-12 мл ацетона. После перемешивания в полученный раствор добавляют несколько капель метилового оранжевого в ацетоне. Образовавшийся раствор желтого цвета разливают в две пробирки. В одну пробирку добавляют воды - сразу же появляется малиновая окраска метилового оранжевого, характерная для кислой среды.
3. В сухую пробирку кладут немного (в объеме горошины) сухой гашеной извести, к которой добавляют примесь порошка фенолфталеина. После перемешивания порошка учащиеся не наблюдают никаких изменений в окраске. При добавлении же воды сразу появляется малиновая окраска, характерная для фенолфталеина в щелочной среде.
Благодаря этим опытам учащиеся убеждаются в том, что концентрированные кислоты не проявляют характерных кислотных свойств. И только под действием воды эти свойства вновь появляются. Значит, сама вода обладает какими-то особыми свойствами. Особенно хорошие результаты получаются при выполнении лабораторных опытов исследовательским методом:
Учитель. Необходимо выяснить, нужен ли растворитель для прохождения химической реакции и важна ли в этом случае природа растворителя. Например, если взять концентрированную серную кислоту и опустить в нее цинк, произойдет ли химическая реакция?
Учащийся. Да, реакция пойдет, так как цинк активнее водорода и вытеснит его из кислоты (пишет на доске уравнение реакции).
Учитель (дает указание провести опыт, учащиеся выполняют его). Выделяется ли водород? Учащийся. Нет!
Учащийся. У меня немного выделяется! Учитель. Перелейте содержимое пробирки в пробирку с водой. Учащийся. У-у-у! Как пощла реакция! Как горячо! Учитель. Обратите внимание, без воды реакция почти не шла, хотя вода при обычных условиях не взаимодействует с цинком.
После этого учащиеся записывают результаты опыта и переходят к следующему опыту. Затем делают выводы о роли воды, о распаде электролитов в полярных растворителях, о том, что вода в химических реакциях не пассивная среда, а под ее влиянием вещества испытывают изменения, Исследования показали, что по истечении пяти месяцев после прохождения теории электролитической диссоциации учащиеся, изучавшие ее исследовательским методом, знали о роли воды в процессе растворения в ней электролитов, не допускали "фарадеевской ошибки". Учащиеся же, изучавшие этот вопрос точно по учебнику, допускали эту ошибку, они обычно ссылались на опыт пропускания электрического тока через электролиты; происходило невольное запутывание учащихся этим опытом. Об этом говорит, например, следующий ответ ученика:
"Если через какую-либо кислоту, соль или основание пропустить электрический ток, то они не будут распадаться на ионы. Но если кислоту, соль или основание растворить в воде, то при пропускании через эти растворы электрического тока растворы распадутся на ионы. Следовательно, при наличии воды в кислотах, щелочах или солях они распадаются на ионы". Как видно из этого ответа, учащиеся запомнили только результат опыта, а объяснить его не могли. Очевидно, заученный. по учебнику материал (о роли воды) приводит их к неверному выводу. Поэтому в ответе учащихся сохраняется объяснение причин диссоциации: действие тока и действие воды.
Процесс растворения электролитов в воде. Первый урок по этой теме следует начать с повторения учения о валентности и химической связи. С этой целью нужно напомнить учащимся об ионной связи и структуре кристаллов поваренной соли, о ковалентной связи, о структуре молекул воды. После этого можно рассмотреть растворение соли в воде как взаимодействие ионов натрия и хлора с полярными, молекулами воды и образование гидратов этих ионов (рис. 59).
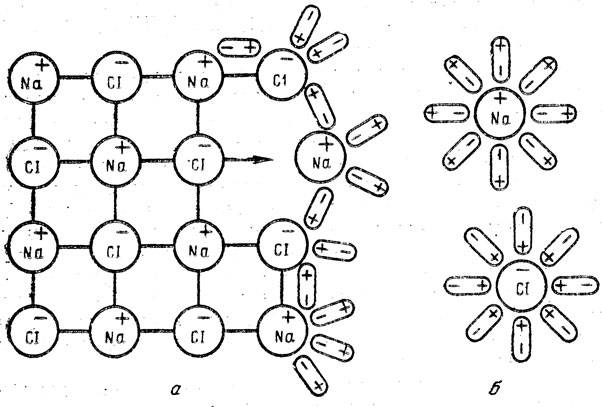
Рис. 59. Схема взаимодействия ионов натрия и хлора с полярными молекулами: а - часть кристаллической решетки, б - гидратированные ионы натрия и хлора
Затем можно рассказать, как взаимодействуют полярные молекулы электролита с полярными молекулами воды (рис.60).
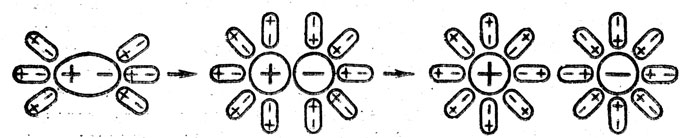
Рис. 60. Взаимодействие полярных молекул растворяющегося вещества с молекулами воды
В результате такой беседы учащиеся приходят к основным положениям ионной теории дедуктивным путем, развивая логически учение электронной теории о химических связях. Чтобы доказать, что в растворах действительно существуют частицы, имеющие электрические заряды, следует показать движение ионов в растворе при прохождении через него постоянного электрического тока, прежде всего движение в растворе ионов водорода. Для этого можно продемонстрировать опыт (рис. 61). На стеклянную пластинку размером приблизительно 9×12 см кладут такого же размера лист фильтровальной бумаги, смоченный раствором хлорида натрия, к которому добавляют раствор индикатора на ион водорода (лакмус или метиловый оранжевый). На противоположные концы бумаги накладывают и плотно прижимают медные пластинки, к которым присоединены провода электрического тока, а на середину листа бумаги кладут толстую нитку, смоченную соляной кислотой, и провода подключают к источнику постоянного электрического тока. Ионы водорода передвигаются к катоду. Поэтому индикатор оставляет на бумаге красную (или розовую) полосу, идущую от нити только в одну сторону - к катоду. Таким же образом можно показать движение гидроксильных ионов при прохождении через раствор электрического тока. В этом случае к раствору соли добавляют в качестве индикатора фенолфталеин, а толстую нить смачивают концентрированным раствором щелочи.
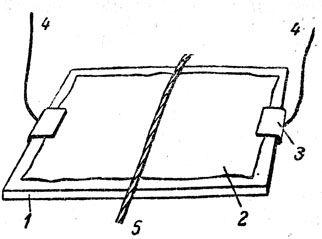
Рис. 61. Движение водородных (или гидроксильных) ионов при прохождении через раствор постоянного электрического тока: 1 - стеклянная пластинка, 2 - фильтровальная бумага, смоченная раствором электролита, 3 - медные пластинки, 4 - электрические провода, 5 - нить, смоченная раствором кислоты или щелочи
Более простым для выполнения, но более сложным для объяснения является опыт, показывающий движение перманганат ионов в растворе, через который пропускают электрический ток; Сделать это можно таким образом: небольшое количество кристаллов перманганата завернуть в фильтровальную бумагу и поместить в середину дугообразной трубки, затем туда же прилить разбавленного раствора селитры. Как только перманганат растворится, в нижней части трубки окажется фиолетовый раствор, а в верхней - бесцветный раствор селитры. После этого следует опустить электроды в раствор селитры так, чтобы они не достигали раствора перманганата и пропустить постоянный электрический ток. Через 2-3 мин обнаруживается, что фиолетовая окраска раствора распространяется снизу вверх в той части колена трубки, в которую погружен анод.
Опыт по движению окрашенных ионов можно провести в U-образной трубке, как и в опыте с перманганатом калия. Для этого в трубку наливают раствор медного купороса, в который прибавляют немного серной кислоты и бихромата калия. К этому раствору приливают слой разбавленной серной кислоты (1:5). Чтобы не было перемешивания раствора, на раствор медного купороса и бихромата калия опускают кружок корковой пробки толщиной в 1-2 мм. Этот кружок должен свободно входить в колено трубки. На центр кружка из пипетки осторожно наливают раствор серной кислоты, который спокойно проходит в зазор между стенками кружка U-образной трубки. Кружок постепенно всплывет, и под ним остается совершенно прозрачный раствор серной кислоты. Затем точно так же наливают раствор серной кислоты и во второе колено трубки. Кружок из трубки вынимают при помощи проволоки или за привязанные к нему тонкие ниточки. В раствор серной кислоты опускают угольные электроды, соединенные с источником постоянного тока. Через несколько минут в катодном пространстве появляется голубое кольцо (ионы меди), а в анодном пространстве - желто-оранжевое кольцо (бихромат-ионы). При длительной работе прибора на катоде, где выделяется водород, угольный электрод распыляется и раствор слегка темнеет.
После того как будет доказано нахождение ионов в растворах кислот, щелочей и солей, можно уточнить, на какие именно ионы диссоциируют молекулы кислот, щелочей и солей. Для этого следует повторить реакции обмена, происходящие в растворе, между кислотами, основаниями и солями и предложить учащимся проделать следующие опыты: 1) взаимодействие сульфата меди с нитратом бария и с хлоридом бария; 2) взаимодействие нитрата серебра с соляной кислотой и с хлоридом натрия; 3) взаимодействие сульфата меди с различными щелочами.
На основании разбора этих реакций учащиеся должны сделать выводы:
1. Гидроксильные группы и кислотные остатки реагируют в водных растворах как самостоятельно существующие частицы.
2. Образование новых молекул в результате реакции обмена происходит так, что кислотные остатки обмениваются местами с гидроксильными группами и с другими кислотными остатками,
3. Гидроксильные группы, кислотные остатки, водород кислот и металлы солей являются теми электрически заряженными частицами, которые находятся в растворах кислот, щелочей и солей.
После этого можно кратко изложить основные положения теории электролитической диссоциации. Нужно вспомнить, какие трудности преодолел в свое время С. Аррениус, защищая свою теорию перед маститыми учеными того времени, не признававшими ее главным образом потому, что не было известно различие между атомами и ионами. Поэтому нужно в течение всего времени изучения теории электролитической диссоциации и впоследствии при пользовании ею отметить, что атомы и ионы одного и того же названия обладают различными химическими свойствами и что ионы имеют электрические заряды, а атомы нейтральны.
После изложения основных положений теории электролитической диссоциации следует провести сравнения свойств атомов, молекул и ионов. Можно сравнить для примера свойства атомарного и молекулярного хлора со свойствами ионов и их отношения к металлам, водороду, иону серебра, а также свойства металлического натрия сравнить с ионами натрия. Рекомендуется решить несколько примеров и задач такого содержания:
1. Среди образцов металлов найти медь, а среди растворов солей найти такие, в которых находится ион меди.
2. Среди растворов, содержащих различные ионы, найти такие, в которых находится ион хлора, ион брома, ион йода.
3. Выяснить, содержится ли ион хлора в растворе бертолетовой соли.
Чтобы отметить общий и характерный для ионов признак - наличие электрических зарядов, необходимо сообщить учащимся, что водные растворы проводят электрический ток только в том случае, если в них находятся ионы. Для определения электропроводности (качественно) можно воспользоваться одним из приборов, изображенных на рисунках 43 и 44. Сравнивая электропроводность растворов кислот, солей, щелочей, сахара, спирта, следует отметить, что не во всяком растворе может происходить электролитическая диссоциация растворяемого вещества, что при растворении в спирте, бензине и в других растворителях электролитической диссоциации может и не быть. Для доказательства этого можно сравнить электропроводность раствора одного и того же вещества в различных растворителях, например: соли кобальта в воде и в спирте, бромной меди в воде и в ацетоне. При этом нужно обратить внимание на различную окраску растворов каждой из этих солей в зависимости от растворителя и связать это с нахождением в растворах в одном случае молекул, а в другом - ионов растворимого вещества.
После этого можно сформулировать новое определение кислоты, основания и соли на основе ионной теории.
В качестве упражнений можно предложить учащимся решить задачу: пользуясь прибором для обнаружения электропроводности, определить, в каких из следующих растворов содержатся ионы и какие растворы являются молекулярными: водные растворы виноградного сахара, сульфата натрия, гидроокиси калия, азотной кислоты, спиртовой раствор соли кобальта, водный раствор той же соли.
Слабые и сильные электролиты. Учитель обращает внимание учащихся на то, что процесс диссоциации является обратимым, поэтому часть молекул распадается на ионы, которые, сталкиваясь между собой, образуют молекулы исходного вещества. Диссоциацию надо рассматривать как обратимый процесс, где наряду с распадом молекул электролита наблюдается соединение ионов в молекулы - моляризация, например:
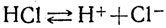
Из этой схемы видно, что не все молекулы электролита диссоциировали на ионы. Поэтому приходится вводить какую-то меру, характеризующую степень электролитической диссоциации. Эта степень показывает отношение числа распавшихся на ионы молекул к общему числу молекул:

1 (α - степень электролитической диссоциации, выражается в процентах.)
Известно, что по теории сильных электролитов Дебая - Гюккеля, предложенной еще в 1923 г., сильные электролиты практически полностью диссоциированы на ионы не только в разбавленных растворах, но и в растворах любой концентрации. (Хотя разбавление указывает на увеличение степени диссоциации.)
Это объясняется сильным электростатическим воздействием конов, в результате чего каждый ион в растворе окружен как бы "шубой", состоящей из противоположно заряженных ионов, поэтому создается впечатление, что электролит не полностью ионизирован на отдельные ионы. Ознакомление учащихся со степенью диссоциации позволяет правильно сформировать понятия о силе кислот и оснований. В педагогической практике учащиеся часто называют ту кислоту сильной, которая устойчива при высоких температурах, разрушает органические ткани или "вытесняет" другие кислоты из солей. Например, можно услышать, что соляная кислота слабее серной, так как вторая вытесняет первую из ее солей в реакциях обмена. Поэтому беседу о силе кислот следует начать с того, что свойства, общие для всех кислот, обусловливаются наличием водородных ионов в растворе, активность кислоты зависит от концентрации водородных ионов в растворе. Для сравнения рекомендуется взять концентрированные серную и уксусную кислоты, потому что они резко различаются по силе. Можно показать такой опыт.
В два цилиндра наливают по 50 мл насыщенного раствора метилового оранжевого в ацетоне. В один стакан добавляют 1-2 капли концентрированной серной кислоты. Раствор сразу же приобретает малиновую окраску. Для того чтобы во втором стакане появилась такая же окраска, концентрированной уксусной кислоты приходится добавлять в десять раз больше, так как степень диссоциации ее незначительна и, следовательно, концентрация водородных ионов в ней невелика. Можно показать и другой опыт. В сосуд с дистиллированной водой опускают электроды от прибора, которым обнаруживается электропроводность. При той незначительной электропроводности, которой обладает чистая вода, нити лампы не накаливаются. Затем учитель прибавляет по каплям децинормальный раствор испытуемой кислоты (0,1 н.), помешивая жидкость после прибавления каждой капли.
Как только обнаружится достаточно ясно накал нити, приливание раствора прекращают и записывают количество капель кислоты, прилитых к дистиллированной воде. После этого сосуд освобождают от раствора кислоты, промывают дистиллированной водой, наливают новую порцию воды и приливают по каплям раствор другой испытуемой кислоты до тех пор, пока накал нити электролампочки не станет таким же, как и в первом опыте. По количеству капель раствора электролита, прилитых к дистиллированной воде, судят об относительной его электропроводности: чем меньше потребовалось электролита, тем лучше его электропроводность.
Так как испытывают растворы кислот одинаковой концентрации, то учащимся нетрудно понять, что причиной лучшей электропроводности раствора серной кислоты является более полная ее диссоциация. Таким образом, учащиеся получают первые представления о степени диссоциации кислот в растворах, о силе кислот. Можно им объяснить еще раз реакцию замещения водорода в кислоте металлом, используя знания теории электролитической диссоциации, и поставить вопрос о зависимости скорости этих реакций от степени диссоциации кислот. Сначала, этот вопрос решают теоретически, сопоставляя скорость реакции с концентрацией ионов реагирующих веществ. В данном случае важно указать на прямую зависимость скорости реакции замещения от концентрации ионов водорода в растворе. Чтобы проверить этот вывод, в две пробирки (рис. 62) наливают одинаковые количества нормальных растворов кислот (уксусной и соляной). Опускают в них кусочки ленты магния, быстро закрывают пробирки пробками с газоотводными трубками, концы которых подводят в бюретки, опрокинутые в сосуд с водой. О скорости выделения водорода в каждой пробирке можно судить по понижению уровня воды в бюретках. Сопоставляя результаты наблюдений, учащиеся без труда поймут, что сила кислот и оснований определяется степенью их электролитической диссоциаций. Остается лишь указать, какие кислоты относятся к сильным, какие к слабым.
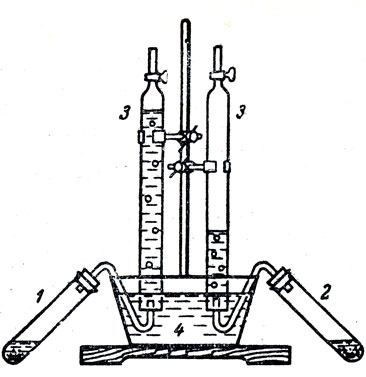
Рис. 62. Сравнение скоростей реакций, происходящих между уксусной и соляной кислотами: 1 - пробирка с уксусной кислотой, 2 - пробирка с соляной кислотой, 3 - бюретки, наполненные водой, 4 - пневматическая ванна с водой
Химические реакции в объяснении ионной теории. После ознакомления учащихся с основными положениями теории электролитической диссоциации следует показать применение этой теории для объяснения химических реакций в растворах, проводящих электрический ток. С этой целью нужно рассмотреть реакции замещения и обмена. Но прежде чем приступить к изучению этих реакций, необходимо повторить определения понятий о кислоте, щелочи и соли на основе ионной теории. При этом можно остановиться на следующих примерах:
1. Перемещение электронов от атомов к ионам (вытеснение металлами водорода и вытеснение одного металла другим).
2. Перемещение электронов от ионов к атомам (вытеснение одного галогена другим и т. д.).
Учащиеся делают вывод о том, что при реакциях замещения металлом водорода в кислоте или металла в соли электроны от атомов металлов переходят к ионам водорода или ионам металлов.
Примером реакции замещения может служить взаимодействие цинка с разбавленной серной кислотой.
Zn+2H++S042-=Zn2++S042-+H2
Zn+2H+=Zn2++H2.
Это также можно показать на примере вытеснения брома хлором из раствора бромидов и серы из раствора сульфидов. Уравнения этих реакций можно записать так:
Сl2+2К++2Вr-=2Сl-+2К++Вr2
Сl2+2Вr-=2Сl-+Вr2
Cl2+2H++S2-=2Cl-+2H++S
Cl2+S2-=2Cl-+S
Из анализа этих процессов учащиеся могут сделать вывод, что простые анионы могут отдавать свои электроны атомам не-V металлов. Обобщая оба вывода, учащиеся записывают, что реакции замещения состоят в том, что электроны переходят от одних атомов или ионов к другим ионам или атомам, а также отмечают, что эти реакции относятся к окислительно-восстановительным.
Изучение реакций обмена можно начать с реакции нейтрализации, затем рассмотреть реакции, в результате которых получаются нерастворимые или газообразные вещества. Лучше разбирать такие реакции нейтрализации, в результате которых получаются вода и нерастворимая соль, так как на этих примерах можно особенно ярко видеть уменьшение электропроводности растворов вследствие соединения ионов, находящихся в растворе, в молекулы.
В качестве примера рекомендуется продемонстрировать нейтрализацию серной кислоты гидроокисью бария (рис. 63). Для этого опыта приготовляют насыщенный раствор гидроокиси бария и разбавленный раствор серной кислоты. Концентрацию этих растворов можно вычислить на основании растворимости гидроокиси бария при комнатной температуре (около 0,18 моля или 0,36 г·экв/л). Раствор серной кислоты должен быть примерно такой же концентрации.
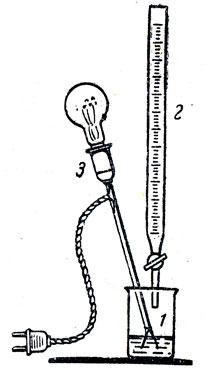
Рис. 63. Изменение электропроводности раствора гидроокиси бария при нейтрализации ее кислотой: 1 - стакан с раствором едкого бария, 2 - бюретка с раствором серной кислоты, 3 - прибор для обнаружения электропроводности раствора
Раствор гидроокиси бария вместе с индикатором фенолфталеином следует налить в стаканчик, опустить туда же электроды от прибора (для наблюдения электропроводности раствора). По накалу нити лампочки видно, что этот раствор хорошо проводит электрический ток. При приливании из бюретки небольшими порциями серной кислоты можно наблюдать (по накалу нити лампочки) постепенное уменьшение электропроводности раствора. Приливая далее осторожно кислоту, можно добиться одновременного изменения окраски индикатора и прекращения накала нити в лампочке прибора. Ионное уравнение этой реакции может быть только полным, так как все ионы участвуют в реакции:
Ba2++2ОH-+2H++SО42-=BaSО4+2H2О
После этого следует рассмотреть реакции нейтрализации, в результате которых получаются растворимые соли, т. е. происходит соединение только водородных и гидроксильных ионов, а катионы и анионы солей остаются в растворе. В данном случае следует записать уравнения реакции в ионном виде:
Na++OH-+H++Cl-=H2О+Na++Cl-
ОН-+Н+-Н2О
При сравнении нескольких реакций нейтрализации щелочей кислотами нужно обратить внимание учащихся на то, что во всех реакциях нейтрализации кислот щелочами происходит образование молекул воды из водородных и гидроксильных ионов.
После этого учитель рассматривает несколько примеров обменных реакций, в результате которых получаются нерастворимые в воде твердые или газообразные вещества. Примеры таких реакций известны учащимся. Достаточно напомнить некоторые из них и показать соответствующие опыты, например: взаимодействие сульфата натрия и хлорида бария, едкого кальция и карбоната натрия (образование нерастворимых солей) и действие соляной кислоты на карбонат кальция или на сульфит натрия (образование газообразного продукта реакций).
Анализируя эти реакции на основе теории электролитической диссоциации, учитель выявляет как общее для них образование из ионов молекул малодиссоциирующих веществ. В некоторых случаях продукты необратимых реакций выходят из сферы реакции в виде нерастворимого в воде осадка или газа, в случае же нейтрализации - малодиссоциирующим веществом является вода.
Для каждой из этих реакций рекомендуется записать ионные уравнения:
Ba2++2Cl-+2H++SО42-=BaSО4+2H++SО42-
Ba2++SО42-=BaSО4
Затем можно разобрать два-три примера обратимых реакций обмена.
В заключение нужно сравнить на основе ионной теории реакции обмена и замещения. Реакции замещения состоят в том, что электроны от одних атомов или ионов перемещаются к другим атомам или ионам. Такие реакции относятся к окислительно-восстановительным (проходят с изменением валентности). При реакциях же обмена происходит соединение ионов в молекулы (валентность при этом не изменяется).
Гидролиз солей. Понятие о гидролизе расширяет и углубляет знания учащихся о растворах, теории электролитической диссоциации и имеет огромное практическое значение в жизни человека. Различные процессы в почве нельзя понять без знания гидролиза, невозможно объяснить применение многих солей, которые повседневно использует человек (сода, мыло, и др.). Для того чтобы подойти к гидролизу, учащимся дают испытать универсальным индикатором растворы таких солей, которые при гидролизе имеют кислую и щелочную реакции: хлорид цинка, хлорид меди, карбонат натрия, фосфат натрия и др. После этих опытов у учащихся может возникнуть представление о том, что соли реагируют с водой, которая диссоциирует на ионы водорода и гидроксила:
Н2О=Н++ОН-
При растворении многих солей в воде ионы реагируют- с водой так, что частично связываются ионы водорода или гидроксила, в результате чего среда получается кислая или щелочная. Так, при растворении соды связываются ионы водорода воды за счет образования бикарбоната:
2Na++CО32-+HOH 2Na++HCО3-+OH-
2Na++HCО3-+OH-
 2Na++HCО3-+OH-
2Na++HCО3-+OH-или сокращенно:
СО32-+НОН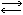 НСО3-+ОН-
НСО3-+ОН-
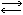 НСО3-+ОН-
НСО3-+ОН-Таким образом, накопление щелочи идет за счет гидролиза соды, поэтому она и используется при стирке. Учащиеся на основе этого примера приходят к выводу, что при гидролизе слей, образованных слабой кислотой и сильным основанием, получается щелочная среда. А как подвергаются гидролизу соли, образованные сильной кислотой и сильным основанием? Очевидно, среда будет нейтральной, так как кислоты и щелочи, получающиеся при гидролизе такой соли, опять диссоциируют. Для того чтобы выяснить, как гидролизуются соли, образованные слабой кислотой и слабым основанием, учащиеся проделывают опыт: в пробирку наливают раствор хлорида или сульфата алюминия и раствор соды. Отмечают образование осадка и выделение пузырьков какого-то газа:
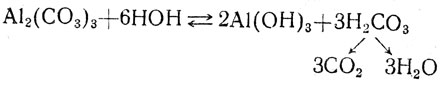
Таким образом, соли слабых кислот и оснований подвергаются полному гидролизу. Учащимся предлагается посмотреть на таблицу растворимости и объяснить, почему в ней поставлены черточки. Затем учитель задает вопрос, выясняющий знания учащихся об условиях, влияющих на скорость химических реакций. Обычно они в первую очередь отмечают температуру, давление, катализатор, поверхность соприкосновения реагирующих веществ. Если учащиеся не назовут роль концентрации реагирующих веществ, то об этом напоминает им учитель. После этого рассматривают, какое значение имеет концентрация реагирующих веществ при гидролизе. Для разрешения этого вопроса надо вспомнить о концентрации водородных ионов. Если концентрация их возрастает, то увеличивается и степень гидролиза.
Концентрация водородных ионов и температура влияют на скорость гидролиза,
При изучении гидролиза следует отметить влияние его на жизнедеятельность человека, указать, что в крови имеются вещества, поддерживающие постоянную концентрацию ионов водорода. Поэтому человек может употреблять пищу с различной концентрацией ионов водорода без вреда для здоровья. Пища, принятая человеком и животным, также подвергается гидролизу. Можно отметить большое значение гидролиза для очистки воды, крашения и др.
Изменение свойств гидроокисей элементов. Этот вопрос целесообразно начать с повторения, дать учащимся самостоятельное задание: написать в ионной форме диссоциацию кислот (соляная, серная, фосфорная) и оснований (гидроокись натрия, гидроокись кальция, гидроокись магния). Затем учащиеся получают гидроокись алюминия и действуют на нее кислотой и щелочью. После этого учитель отмечает, что гидроокись алюминия в небольшой степени растворима и в растворе диссоциирует как основание. Но почему же она в определенных условиях ведет себя как кислота? Для того чтобы объяснить это явление, следует сопоставить диссоциацию оснований, кислот и амфотерных гидроокисей. Если при диссоциации отщепляются ионы гидроксила, то это основание, а если ионы водорода - кислота. Это можно выразить в общем виде: ЭОIНII, где Э - элемент, пунктиром показаны разрывы молекул при диссоциации: I - диссоциация по основному типу, II - диссоциация по кислотному типу. От чего же зависит тот или иной тип диссоциации? Если связь центрального атома (металла или неметалла) с кислородом прочнее связи с водородом, то при диссоциации образуются только ионы водорода. И наоборот, когда связь центрального атома с кислородом менее прочна, чем с водородом, то отщепляются ионы гидроксила. У амфотерных гидроокисей связь центрального атома и с водородом и с кислородом примерно одинакова. На рисунке 64 пунктирной линией показаны места возможного разрыва связи в молекуле при диссоциации, даны величины радиусов ионов в ангстремах:
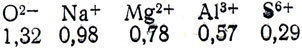
С увеличением заряда центрального атома и уменьшением его радиуса связь его с атомом кислорода усиливается ив тоже время ослабляется связь с ИОНОМ водорода. Так, у гидроокиси натрия заряд центрального атома (Na+) наименьший, а радиус наибольший, поэтому связь его с кислородом менее прочна, чем кислорода с водородом, в результате чего при диссоциации и отщепляются ионы гидроксила. В гидроокиси магния связь ослаблена (ион магния имеет меньший радиус и больший заряд), поэтому усиливается притяжение его к кислороду и ионы гидроксила отщепляются слабее. На рисунке 64 видно, что от молекулы серной кислоты легко отщепляются ионы водорода (кислород сильно притягивается к небольшому многозарядному центральному атому серы). Ион алюминия имеет большой заряд и маленький радиус, прочность связи между ионом алюминия, кислородом и водородом примерно одинаковы, поэтому это соединение диссоциирует и как основание, и как кислота. Гидроокись алюминия диссоциирует по кислотной и основной схеме, где в равновесии находятся ионы гидроксила и ионы водорода. Если к раствору добавить кислоту (избыток ионов водорода), то ионы водорода (подавляют кислотный тип диссоциации) реагируют с гидроксильными ионами, образуя малодиссоциированные молекулы воды. В результате равновесие сдвигается в сторону образования ионов алюминия. При добавлении же щелочи создается большая концентрация ионов гидроксила (подавляется диссоциация по основному типу), они связываются с ионами водорода, и равновесие смещается в сторону образования алюминат-ионов.
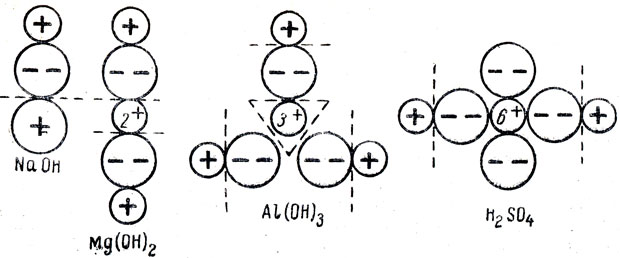
Рис. 64. Схемы диссоциации гидроокисей элементов в зависимости от величины радиуса и валентности центральных атомов
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'