
Бром. Йод. Фтор
При изучении брома следует широко использовать метод сравнения изучаемого галогена с изученным хлором. Сравнение можно начать с их атомных масс, затем перейти к физическим и химическим свойствам, нахождению в природе и т. д. Указания о мерах предосторожности при демонстрации опытов с хлором действительны и при демонстрации опытов с бромом. Если нужно взять небольшое количество брома из склянки, то надо для этой цели пользоваться пипеткой с резиновым шариком и ни в коем случае не засасывать его ртом при помощи обыкновенной пипетки. Следует избегать и переливания брома из одного сосуда в другой вне вытяжного шкафа вследствие большой летучести брома и вредности его паров.
Для ознакомления учащихся с физическими свойствами брома необходимо показать это вещество, соблюдая надлежащую предосторожность, Склянки или пробирки с жидким бромом запрещается выдавать на руки учащимся: попадая на кожу, бром вызывает болезненные повреждения, пары его ядовиты. На основании наблюдений и сообщений учителя учащиеся отмечают состояние, цвет, запах, плотность, летучесть, температуру кипения. Эти свойства сравниваются с соответствующими свойствами хлора.
Различную растворимость брома в воде, бензине и эфире показывают, взбалтывая водный раствор брома с этими растворителями: по интенсивности окраски растворов можно судить о хорошей или плохой растворимости брома в том или ином растворителе.
Для ознакомления с химическими свойствами брома учитель демонстрирует взаимодействие его с металлами и с водородом. Опыт горения натрия в парах брома можно показать в приборе, изображенном на рисунке 69. В пробирку 1 помещают смесь бромистой соли, двуокиси марганца и серной кислоты, в расширенную часть хлоркальциевой трубки 2 кладут маленький кусочек натрия. Опыт начинают с того, что нагревают натрий до плавления ив то же время подогревают смесь в пробирке 1. Как только натрий расплавится, он загорается в парах брома. Избыток брома отводят по трубке в стакан с водой. Опыт небезопасен и требует особой осторожности и предварительной тренировки учителя.
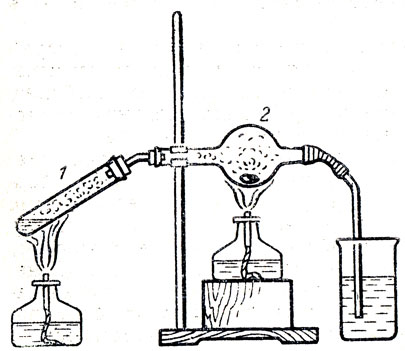
Рис. 69. Горение натрия в парах брома
Соединение брома с железом, марганцом, цинком можно показать, действуя восстановленным железом, или порошком магния, или порошком цинка на бромную воду. При этом вода обесцвечивается.
Эффектно проходит реакция соединения брома с алюминием (рис. 70). В пробирку 1 наливают 2-3 мл жидкого брома и туда же опускают свежеприготовленные тонкие стружки алюминия, после чего пробирку быстро закрывают пробкой с длинной газоотводной трубкой. Реакция начинается через полминуты с сильным разогреванием алюминия. Выходящие из пробирки пары брома охлаждаются в газоотводной трубке и стекают обратно в пробирку, а несгустившиеся пары поглощаются водой в стакане 2.
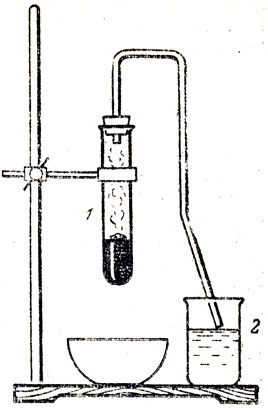
Рис. 70. Горение алюминия на поверхности жидкого брома
Сравнивая условия реакций соединения водорода с хлором и бромом, учащиеся должны отметить, что бром проявляет меньшую активность в этих реакциях, чем хлор. Учитель сообщает, что молекулы бромистого водорода обладают меньшей термической стойкостью, чем молекулы хлористого водорода.
Для сравнения химической активности хлора и брома показательны реакции замещения брома хлором в растворах бромистоводородной кислоты или ее солей. Осуществление этих простых реакций доступно самим учащимся при самом скромном оборудовании химической лаборатории в школе. В пробирку с раствором бромистой соли приливают хлорной воды. Появляется бурая окраска, характерная для брома. Продолжая далее сравнение брома с хлором, следует сообщить, что бром, подобно хлору непосредственно не соединяется с кислородом, а кислородсодержащие соединения брома неустойчивы.
После ознакомления учащихся со свойствами брома можно кратко рассказать о нахождении его в природе. При этом следует обратить внимание на сходство состава солей хлора и бреема и на то, что эти соединения в природе часто сопровождают Друг друга.
Можно указать некоторые области применения солей брома: изготовление лекарственных веществ, фотографических пластинок и пленок. Бром в свободном состоянии применяется в работах по органической химии. Чтобы учащиеся поняли, на чем основано применение бромистых солей в фотографии, следует получить бромид серебра, отфильтровать его, закрыть часть бромида серебра на фильтре темной бумагой и выставить на несколько минут фильтр с бромистой солью на солнечный свет. Вскоре обнаруживается потемнение той части бромида серебра, которая подвергалась действию света.
При изучении йода и его соединений учащиеся могут рассмотреть кристаллы чистого йода и наблюдать его возгонку. Для этого следует нагреть в пробирке кристаллик йода и наблюдать осаждение мелких кристалликов этого вещества на стенках пробирки. Чтобы показать растворимость йода в разных растворителях, можно предложить учащимся проделать следующие опыты:
1) небольшой кристаллик йода опустить в пробирку, прилить в нее воды на 1/3 ее объема и взболтать;
2) полученный раствор слить в другую пробирку, а к оставшемуся твердому йоду прилить 3-4 мл спирта, взболтать и отметить растворимость йода в спирте;
3) к водному раствору йода прилить небольшое количество (1 мл) бензина и взболтать, обратить внимание на окраску бензина и оставшегося водного раствора.
В эту же лабораторную работу можно включить и характерную для йода реакцию с крахмалом. Следует обратить внимание учащихся на то, что посинение крахмала происходит только от свободного йода. Поэтому при выполнении лабораторной работы на крахмал действуют не только раствором йода, но и раствором какой-либо его соли.
Химические свойства йода изучают по общему плану. Можно показать реакции соединения йода с цинком или алюминием. Для этого нужно осторожно смешать небольшое количество измельченного йода с порошком алюминия (или цинка) и прилить 1-2 капли воды или спирта. Реакция происходит очень бурно,
О взаимодействии йода с водородом достаточно лишь рассказать (не показывая опыта), при этом можно сравнить условия синтеза и термическую прочность йодистого, водорода с условиями синтеза и термической стойкостью хлористого и бромистого водорода. Вместе с тем следует отметить значительную активность йода в отношении к водороду, как свободному, так и находящемуся в соединениях, например в органических (кислотах) веществах. Этим объясняются окислительные свойства йода. Сходство химических свойств иодидов со свойствами хлоридов и бромидов учащиеся могут обнаружить при ознакомлении с реакциями обмена йодистых металлов с нитратом серебра.
Для сравнения химической активности галогенов (отношение к металлам и к водороду) следует показать опыты вытеснения йода из растворов его солей хлором и бромом. Учитель предлагает учащимся прилить к растворам йодистых солей бромную и хлорную воду и обнаружить свободный йод крахмалом. Можно пользоваться бумажкой, пропитанной крахмалом.
Ознакомление учащихся с применением йода нужно связать с окислительными свойствами его. Учитель, рассказывая о нахождении йода в природе, указывает на основные источники добычи йода - буровые скважины на нефтяных промыслах. Из способов получения йода следует прежде всего показать вытеснение его хлором из йодистых солей.
При такой подготовке учащихся представляется возможным провести изучение фтора методом беседы, сохраняя интерес их и активное участие в приобретении знаний об этом элементе. Беседа ведется таким образом, что учащиеся могут предвидеть свойства фтора на основании сравнения свойств его е изученными галогенами.
Например, сообщив учащимся атомную массу фтора, учитель предлагает подумать, в каком состоянии (твердом, жидком или газообразном) должен быть фтор при обыкновенной температуре. Учащиеся, сопоставив атомные массы и физические состояния изученных галогенов, безошибочно отвечают на этот вопрос.
Таким же способом учащиеся знакомятся и с другими свойствами фтора: с его плотностью, отношением к водороду и кислороду. После каждого ответа учитель уточняет и дополняет его сообщениями о свойствах фтора.
Таким же способом учащиеся узнают, что фтор обладает наибольшей активностью в отношении к водороду. Учителю остается добавить, при каких условиях происходит соединение фтора с водородом, как он реагирует с водой. О получении фтора говорить не приходится: учащиеся не подготовлены к осознанному усвоению этого способа.
При ознакомлении с фтористоводородной кислотой следует отметить термическую устойчивость ее молекул и то, что она не окисляется теми окислителями, которые реагируют с другими галогеноводородами. Отмечая действие ее на стекло, нужно сообщить учащимся, что эта реакция будет изучаться позже. Из природных соединений фтора достаточно назвать и показать плавиковый шпат и сообщить, как можно получить фтористоводородную кислоту (провести аналогию с получением хлористого водорода действием серной кислоты на соль).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'