
Хлор
Для ознакомления учащихся со свойствами хлора нужно показать им это вещество и продемонстрировать несколько опытов. При этом учителю химии приходится решать довольно сложные задачи: демонстрировать вредные газообразные вещества при непременном условии полной гарантии безопасности опытов для здоровья учащихся. Поэтому учитель обязан при подготовке этих опытов особенно тщательно готовить приборы и предварительно проверять их. Для демонстрации опытов с хлором нужно заранее перед уроком подготовить прибор для получения хлора и наполнить хлором несколько сосудов в соответствии с тем, какие опыты предполагается показывать на уроке.
При получении хлора окислением соляной кислоты двуокисью марганца приходится нагревать реагирующую смесь. В большинстве случаев хлор удается обнаружить лишь тогда, когда выделится заметное количество его в атмосферу, что недопустимо в связи с его вредностью. Кроме того, нельзя быстро прекратить выделение хлора, так как и после прекращения нагревания смеси реакция еще продолжается. Эти недостатки можно устранить, если использовать прибор, изображенный на рисунке 65.
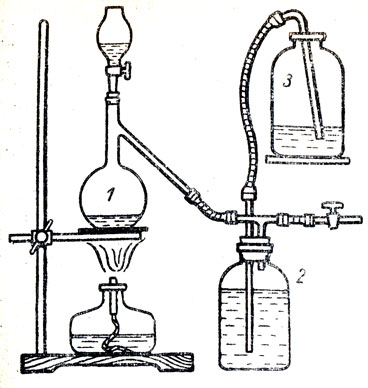
Рис. 65. Прибор для получения хлора: 1 - колба со смесью двуокиси марганца и соляной кислотой, 2 и 3 - склянки с насыщенным раствором хлорида натрия
В колбе 1 получается хлор нагреванием смеси соляной кислоты с двуокисью марганца или с каким-либо другим окислителем. Хлор проходит по трубке, соединенной с тройником и уходит через кран. Как только потребность в хлоре минует, прекращают нагревание колбы и закрывают кран. Тогда хлор, еще продолжающий выделяться, пойдет в склянку 2, содержащую насыщенный раствор хлорида натрия, частично растворится в этой жидкости, а затем вытеснит ее в склянку 3 и займет место вытесненного раствора в склянке 2. При изготовлении этого прибора необходимо соблюдать соответствие между количеством реагирующей смеси и емкостью склянки 3, Если эта склянка очень мала, а реагирующих веществ в колбе много, то после прекращения нагревания может выделиться столько хлора, что вытесненная им вода из склянки 2, переполнит склянку 3 и разольется по столу. При удачно собранном приборе и осторожном нагревании колбы всегда удается предотвратить выделение хлора в атмосферу и иметь наготове хлор, находящийся в склянке 2.
Если учителю нужно небольшое количество хлора (15-20 мл), достаточно открыть кран и взять столько, сколько нужно. Склянку 2 можно предварительно проградуировать, чтобы знать, сколько именно взято газа из прибора. Собирать хлор следует так, чтобы он не попадал в атмосферу. На рисунке 66 показан один из способов наполнения колбы хлором. Склянки или колбы, наполненные хлором, выставляют перед уроком на демонстрационном столе. Ознакомление с физическими свойствами хлора начинается с того, что учитель показывает сосуды, наполненные хлором, и такой же формы сосуды, наполненные воздухом, ставит за каждым сосудом белый экран.
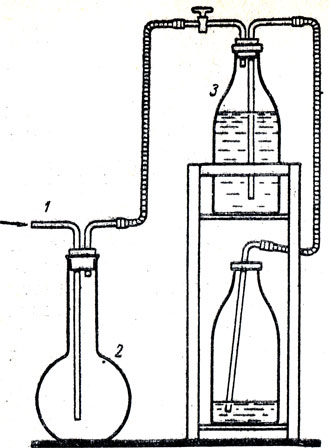
Рис. 66. Наполнение колбы хлором: 1 - стеклянная трубка, по которой хлор поступает из прибора в колбу - 2. Воздух собирается в склянке - 3
Рассказывая о газообразном состоянии хлора, учитель имеет в виду обыкновенные условия. Но нужно сообщить учащимся о том, что хлор легко переходит в жидкое состояние при повышении давления и понижении температуры.
Хорошую растворимость хлора в воде можно показать, воспользовавшись прибором. В колбу, наполненную хлором, при помощи предохранительной воронки наливают 30-40 мл холодной воды и быстро закрывают колбу пробкой, через которую проходит стеклянная газоотводная трубка, конец трубки должен быть опущен в стакан с водой. Затем воду в колбе взбалтывают, чтобы хлор лучше растворился в ней, и наблюдают, как вода поднимается из стакана по газоотводной трубке и переливается в колбу с хлором. Для уточнения следует сообщить учащимся коэффициент растворимости хлора при обыкновенных условиях и напомнить, что растворимость газов изменяется в зависимости от температуры и давления.
Следует показать заранее заготовленную хлорную воду, обратить внимание на окраску этого раствора и сравнить с окраской чистого хлора. После этого можно сделать краткое обобщение о физических свойствах и растворимости хлора в воде и предложить учащимся записать вывод в своих тетрадях.
Для химической характеристики хлора имеет большое значение его отношение к металлам, к водороду и кислороду. Наиболее ценным в методическом отношении опытом является демонстрация горения натрия в хлоре. Опыт можно показать так: в хлоркальциевую трубку, присоединенную к прибору для получения хлора, помещают небольшой кусочек натрия и нагревают его до плавления. Как только металл расплавится, пропускают через трубку хлор и прекращают нагревание трубки. Горение натрия происходит с выделением большого количества теплоты.
Чтобы опыт прошел удачно, необходимо пускать хлор в трубку с натрием в тот момент, когда металл только что расплавится и появится "зеркало", свободное от налетов окислов. Если пропускать хлор над холодным или еще не расплавленным натрием, взаимодействие хлора с металлом происходит не так энергично, а образующаяся на металле твердая корка поваренной соли будет предохранять натрий от дальнейшего действия хлора. Продукт реакции следует показать учащимся, но надо предупредить их, что полученную соль пробовать на вкус нельзя, так как в ней в качестве примеси могут быть остатки натрия, не успевшего прореагировать с хлором. В продуктах реакции может быть и не вступивший в реакцию хлор.
Затем можно показать горение железа в хлоре. Для этого нагревают в железной ложечке восстановленное железо и пересыпают его небольшими порциями в стеклянную банку, наполненную хлором. Учащиеся наблюдают искры и появление бурого дыма. При записи уравнений этих реакций следует обратить внимание на валентность хлора, натрия, железа в соединениях. Появление высшей валентности железа при непосредственном его соединении с хлором свидетельствует о большой активности хлора по отношению к железу. В заключение следует сообщить, что все металлы могут непосредственно соединяться с хлором, но происходят эти реакции с различными тепловыми эффектами.
При изучении реакции хлора с водородом рассматриваются следующие случаи: взаимодействие хлора с водородом в свободном состоянии; взаимодействие хлора с водородом, находящимся в соединении с другими элементами. Сначала смешивают хлор и водород в равных объемах и показывают, что при обыкновенной температуре (без освещения и катализаторов) реакция практически не идет. Затем хлороводородную смесь поджигают. Взрыв и появление тумана свидетельствует о том, что хлор взаимодействует с водородом.
После этого нужно показать спокойное горение водорода в атмосфере хлора и ознакомить учащихся с продуктом этой реакции. Чтобы не было загрязнения воздуха хлором и хлористым водородом, опыт начинают с того, что пускают из аппарата Кип-па слабый ток водорода и зажигают его у конца трубки. Затем опускают осторожно эту трубку в банку с хлором, и, как только весь хлор прореагирует с водородом, горение водорода прекращается. Тогда закрывают кран у аппарата Киппа. При демонстрации этого опыта нужно обратить внимание учащихся на характер пламени и в особенности на продукт горения, напомнить о растворимости хлористого водорода в воде и об образовании соляной кислоты.
Учитель сообщает также, что хлор с водородом соединяется и при обыкновенной температуре, но в присутствии катализатора или при ярком освещении. Следует показать реакцию с углеводородами, например горение ацетилена в атмосфере хлора. Для этого в пробирку с хлором опускают небольшой кусочек карбида кальция и при помощи пипетки или стеклянной трубочки вводят несколько капель воды. Сразу же происходит вспышка ацетилена и выделение копоти. При взаимодействии карбида кальция с водой выделяется ацетилен, с которым и реагирует хлор. Он отнимает от ацетилена водород (образуется хлористый водород), а углерод выделяется в виде сажи. Несколько сложнее проходит опыт горения свечи в хлоре (так как для этого нужно взять большой сосуд с хлором). Но из этих опытов достаточно показать лишь один и при разборе реакции не углубляться в детали. Следует обратить внимание учащихся на то, что во всех случаях происходит соединение хлора с водородом, даже если он находится в соединении с углеродом.
При разборе и составлении уравнения реакции соединения хлора с водородом отмечается валентность хлора. Разбирая реакции, происходящие между хлором и водой, учитель должен рассказать об образовании хлорноватистой кислоты, которая является сильным окислителем (Сl+). Учащиеся должны понять, почему хлор различно действует на красящие вещества сухой и влажной ткани. На этом свойстве хлора основано его применение в текстильной промышленности.
В учебной и методической литературе описано много опытов, которые можно показать для сравнения результатов действия хлора на сухую и влажную ткань. Сухая ткань не отбеливается хлором, поэтому его подсушивают концентрированной сер ной кислотой. Опыт идет хорошо, если одну колбу или цилиндр с концентрированной серной кислотой заполнить хлором и подвесить сухую цветную ткань. В другой сосуд подливают хлорной воды, заполняют его хлором и закрывают пробкой с влажной цветной тканью (рис. 67).
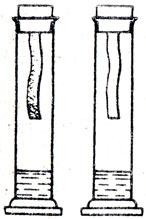
Рис. 67. Влияние влаги на отбеливающее свойство хлора
Продолжая далее характеристику хлора в свободном состоянии, следует показать его отношение к кислороду. Зная химическую активность кислорода и хлора, учащиеся обычно бывают несколько удивлены, когда узнают, что кислород не соединяется непосредственно с хлором. Этим следует воспользоваться для разъяснения понятия "химическая активность". Нужно знать, в отношении каких веществ и при каких условиях тот или иной элемент является активным.
В заключение нужно провести обобщающую беседу о химических свойствах хлора и предложить учащимся кратко записать выводы из наблюдений и заключительной беседы.
Хлор в природе, применение и получение хлора. Из природных веществ, содержащих хлор, изучаются в курсе химии средней школы только хлориды натрия и калия. О залежах хлорида натрия и добывании каменной и самосадочной соли учащиеся узнают на уроках географии и естествознания.
О хлориде калия учащиеся тоже получили некоторые сведения на уроках ботаники и химии, поэтому беседа о нахождении хлора в природе должна быть краткой; имеющей целью повторения, а не изучения нового материала. Учитель перед учащимися ставит вопрос о возможности нахождения хлора в природе в свободном состоянии. Зная химические свойства хлора, учащиеся дают отрицательный ответ.
Ознакомление учащихся со способами получения хлора можно начать с изучения лабораторных способов, а затем перейти к заводским. В учебниках химии обычно получение хлора рассматривается на примере взаимодействия концентрированной соляной кислоты с двуокисью марганца. Поэтому учащиеся запоминают только этот способ и не приобретают общих понятий о способах получения хлора в лаборатории. Чтобы этого не произошло, получение хлора в лаборатории необходимо рассматривать в свете окислительно-восстановительных процессов.
При ознакомлении учащихся с заводскими способами получения хлора следует рассказать об электролизе хлорида натрия. В начале изучения этого процесса следует повторить с учащимися: 1) окислительно-восстановительные реакции (на основе электронных представлений); 2) что называют окислителем, восстановителем; 3) что такое электролиз.
При изучении электролиза хлорида натрия учащиеся конкретизируют свои знания об окислительно-восстановительных процессах. Большие трудности для учащихся представляет понимание электролиза водного раствора поваренной соли, так как в нем, помимо ионов натрия и хлора, находятся ионы водорода и гидроксила. Что же разряжается на аноде и катоде? К катоду подходят как ионы натрия, так и ионы водорода. Учитель сообщает, что для разрядки ионов водорода требуется меньше энергии, чем для разрядки ионов натрия. Поэтому на катоде протекает реакция восстановления водорода и выделяется водород, а не металлический натрий. На аноде легче окисляются ионы хлора, чем ионы гидроксила. Поэтому здесь выделяется газообразный хлор. В растворе накапливаются ионы натрия и гидроксила. При выпаривании такого раствора получают твердый едкий натр.
Прежде чем говорить о применении хлора, следует напомнить учащимся о химических свойствах его (о взаимодействии с водородом и с водой).
После такого разбора учащиеся должны понять, на чем основано применение хлора при отбелке тканей, дезинфекции, в борьбе с вредителями сельского хозяйства.
Хлористый водород и соляная кислота. При изложении этой подтемы следует выделить два основных вопроса: свойства хлористого водорода и соляной кислоты; получение хлористого водорода и соляной кислоты в лаборатории.
Урок можно начать с реакции соединения хлора и водорода; затем следует показать хлористый водород, предварительно собранный в колбу или в склянку, отметить отсутствие окраски, сообщить плотность, напомнить о резком запахе и показать опыт растворения хлористого водорода в воде.
После этого учащиеся рассматривают концентрированную соляную кислоту. Для объяснения того, что она дымит на воздухе, необходимо напомнить об условиях растворимости газов в воде. Затем следует сообщить, что плотность соляной кислоты зависит от ее концентрации, и объяснить, почему соляная кислота не может быть стопроцентной. Химические свойства соляной кислоты известны учащимся из курса химии VII класса, Поэтому достаточно напомнить им о действии соляной кислоты на индикаторы, на металлы, о реакции ее со щелочами и основными окислами. Более подробно следует остановиться на реакции соляной кислоты с раствором нитрата серебра. Эти опыты могут выполнить учащиеся. На этих лабораторных занятиях они не только изучают характерную реакцию на хлор-ион, но и приобретают умение проводить опыты с малыми количествами реактивов. При этом важно обратить внимание учащихся на внешний вид осадка (хлорида серебра), нерастворимость его в азотной кислоте. Для закрепления полученных знаний можно дать экспериментальную задачу: найти соляную кислоту среди растворов Других кислот.
Следующий урок на тему "Получение хлористого водорода и соляной кислоты в лабораторий" лучше начать с теоретического разбора реакции между хлоридом натрия и серной кислотой, затем учащимся надо предложить проделать опыт (рис. 68).
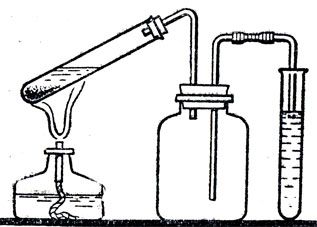
Рис. 68. Получение малых количеств соляной кислоты взаимодействием хлорида натрия с серной кислотой
В пробирку помещают крупнозернистый хлорид натрия и приливают 70-процентную серную кислоту. Склянка служит предохранителем от перебрасывания воды в пробирку.
Хлористый водород поглощается водой в пробирке. Конец трубки должен едва касаться поверхности воды.
Следует обратить внимание учащихся на появление струек в жидкости, идущих сверху вниз: получающаяся соляная кислота, как более тяжелая жидкость, опускается на дно пробирки. Полученную кислоту учащиеся должны исследовать: испытать лакмусом, подействовать ею на цинк, на раствор нитрата серебра. При анализе опыта необходимо отметить, что реакция идет до конца потому, что хлористый водород удаляется из сферы реакции.
Беседа о применении соляной Кислоты должна быть краткой, так как при ограниченных знаниях по химии учащиеся не могут понять всего многообразия областей, где используется соляная кислота. Можно сообщить о применении ее для нейтрализации щелочей, для очистки поверхности металлов от окислов при паянии, в обработке костей при варке клея (переведение нерастворимого фосфата кальция в растворимую гидросоль) и др. Из солей соляной кислоты достаточно назвать наиболее распространенные в природе - хлорид натрия и хлорид калий, а также те соли, с которыми учащимся приходится иметь дело в школьной лаборатории, - хлорид железа, хлорид меди, хлорид серебра. Ознакомление с хлоридами должно быть проведено в форме демонстраций, а также рассмотрения их растворимости. Следует обратить особое внимание учащихся на нерастворимость хлорида серебра не только в воде, но и в кислотах. Можно организовать лабораторное занятие для изучения реакций, характерных для растворимых хлоридов (реакция на хлор-ион). Соответствующие опыты описаны в учебнике.
Кислородсодержащие соединения хлора. Ознакомить учащихся с некоторыми кислородсодержащими соединениями хлора необходимо по следующим мотивам: 1) кислотные свойства окислов хлора характеризуют его как неметалл; 2) знания высшей валентности хлора в соединениях его с кислородом поможет понять положение хлора в VII группе периодической системы; 3) соли хлорноватистой кислоты имеют большое промышленное значение, а бертолетова соль применяется в медицине, в лабораториях и в пиротехнике. Отбирая учебный материал к уроку на эту тему, следует учесть небольшое число часов, которое может быть отведено на ее изучение. Поэтому необходимо ограничиться рассмотрением свойств и состава следующих веществ: хлорноватистой кислоты, белильной извести и бертолетовой соли.
При изучении реакции с водой учащиеся уже ознакомились с образованием хлорноватистой кислоты. Теперь им нужно напомнить об этом, а затем разобрать кратко реакцию получения белильной извести при действии хлора на известь. После этого следует разобрать взаимодействие этой соли с угольной кислотой и с водой, так как на этих реакциях основано применение ее как заменителя хлора. Бертолетову соль необходимо показать как окислитель и термически нестойкое вещество.
В заключение следует отметить переменную валентность хлора в соединениях с кислородом и постоянную валентность в соединениях с водородом и металлами. Как пример соединения, в котором проявляется высшая валентность хлора, можно привести хлорную кислоту или ее соль.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'