
Сера
Изучать химические свойства серы можно по тому же плану, который был принят при изучении галогенов (взаимодействие с водородом, с металлами, с кислородом). Перед ознакомлением учащихся с реакцией соединения серы с водородом учитель напоминает, как и при каких условиях соединяются хлор и кислород с водородом, а затем уже ставит вопрос: может ли сера при тех же или других условиях непосредственно соединяться с водородом? Составив с учащимися уравнение предполагаемой реакции, учитель обращает внимание на возможность образования сероводорода, некоторые свойства которого известны учащимся из курса VII класса. Опыты синтеза сероводорода можно провести в виде демонстрации или лабораторной работы.
В хлоркальциевую трубку кладут немного серы. Один конец трубки закрывают пробкой с изогнутой газоотводной трубкой, которую опускают в стакан, с раствором нитрата свинца или медного купороса (рис. 71, а). С другого конца трубку соединяют с прибором для получения водорода (аппаратом Киппа или каким-либо другим прибором). Проверяют водород на чистоту. После этого нагревают серу. Водород реагирует с серой, и образуется сероводород (это можно обнаружить по выделению черного осадка сульфида свинца или меди). Если учащиеся еще не знают реакций между сероводородом и солями, то целесообразно в стакан наливать не растворы солей свинца или меди, а воду. После образования сероводородной воды ее дают понюхать учащимся.
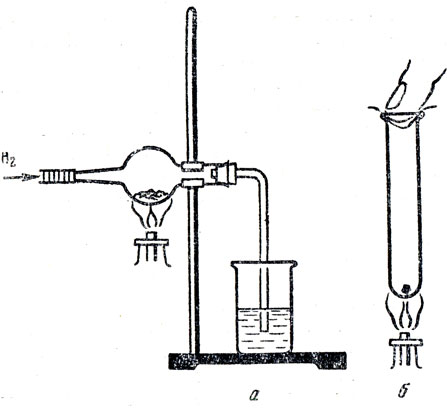
Рис. 71. Получение сероводорода
Взаимодействие водорода с серой можно показать в пробирке (рис. 71, б). В пробирку кладут кусочек серы величиной с горошину и подогревают дно пробирки, чтобы сера прилипла к стеклу. После остывания пробирки в ее отверстие помещают влажную синюю лакмусовую бумажку так, чтобы она прилипла к стенкам пробирки. Пробирку опрокидывают вверх дном и заполняют водородом. После этого отверстие пробирки закрывают вдвое сложенным листком чистой белой бумаги, смоченной раствором нитрата свинца (пробирку держат вверх дном!). Бумагу вдавливают большим пальцем в пробирку. Затем ее перевертывают отверстием вверх и, продолжая держать отверстие пробирки пальцем, нагревают серу до кипения. Лакмусовая бумажка краснеет, фильтровальная бумага покрывается темным налетом сульфида свинца. Если отнять палец от пробирки и понюхать, то ощущается запах сероводорода. Полезно сравнить синтез сероводорода с синтезом воды и хлористого водорода. Сходство состоит в том, что эти реакции начинаются при нагревании смеси реагирующих веществ. Различаются же они тем, что водород соединяется с серой не так энергично, как с хлором и с кислородом.
Сравнивая химическую активность серы и хлора по отношению к водороду, следует напомнить учащимся о том, что хлор соединяется не только со свободным водородом, но отнимает последний из соединений с другими элементами, например из углеводородов. Для проведения аналогии можно взять самые малые количества серы и парафина, нагреть их в пробирке с газоотводной трубкой, конец которой погружают в воду. Появление сероводорода в растворе обнаруживается так же, как и в предыдущем опыте.
Необходимо отметить постоянную валентность серы в соединении с водородом и увеличение ее на единицу по сравнению с валентностью хлора.
Изучение реакций соединения серы с металлами можно начать с известной учащимся реакции получения сульфида железа, затем показать опыт соединения серы с натрием. Для этого помещают в фарфоровую ступку маленький кусочек натрия и примерно в два раза больше порошкообразной серы. Сильно нажимая на пестик, вдавливают серу в металл и одновременно растирают смесь. Происходит вспышка с сильным треском и разбрызгиванием искр. Чтобы предохранить руку от повреждения, рекомендуется надеть перчатку или обернуть руку полотенцем. Ступку нужно держать отверстием в сторону от учащихся.
Более простыми и менее опасными являются опыты соединений серы с алюминием или цинком. Небольшое количество смеси порошкообразного алюминия (или цинка) и серы помещают на тонкую металлическую пластинку, укрепляют ее в штативе и нагревают то место, где находится смесь. Когда обнаружится плавление серы в смеси, можно коснуться ее накаленной проволокой или стеклянной палочкой. Происходит вспышка. Часть продуктов реакции остается на пластинке.
Следует сравнить реакции серы, хлора, кислорода с металлами и отметить валентность серы в сульфидах.
Для химической характеристики серы как элемента VI группы периодической системы необходимо напомнить учащимся о существовании высшего окисла - трехокиси серы. Сравнивая реакции серы и хлора с кислородом, учитель имеет возможность отметить большую активность серы и уменьшение на единицу валентности серы в кислородных соединениях.
Сера в природе. Применение и получение серы. Чтобы установить связь между свойствами серы и ее нахождением в природе, применением и получением, необходимо вспомнить о взаимодействии серы с другими элементами. При этом важно отметить температурные условия этих реакций (сравнительно малую химическую активность серы при низкой температуре), чтобы учащиеся поняли, почему сера встречается в природе в свободном состоянии.
Вначале следует назвать важнейшие месторождения серы в СССР, а затем указать залежи ее в других странах, имеющие мировое значение (Италия и США). После того как учащиеся узнали о взаимодействии серы с металлами, им должно быть понятно нахождение в природе сульфидов. Некоторые образцы минералов, содержащих эти соединения, нужно показать на уроке. Нахождение в природе сульфатов следует связать с гидратацией серного ангидрида и образованием при этом серной кислоты, солями которой и являются сульфаты. Нужно сообщить, что сера - важный и распространенный элемент в органическом мире, так как она входит в состав белковых веществ.
Ознакомление учащихся с добычей и получением серы не предусмотрено программой по химии. Но, учитывая большое значение серы для промышленности и сельского хозяйства, следует сообщить о том, из чего и как получается сера. Знания свойств серы помогают учащимся понять основные принципы промышленных способов получения ее. Сера в природе находится в смеси с другими веществами или в химических соединениях (в сульфидах, сульфатах, органических веществах), поэтому можно указать некоторые способы ее получения: а) выплавка самородной серы; б) получение серы из химических соединений.
Необходимо сообщить учащимся, что получение самородной серы из смеси с другими минеральными веществами основано на том, что сера нерастворима в воде и температура ее плавления ниже температур плавления веществ, с которыми она смешана. Поэтому смесь нагревается (под землей или на поверхности земли) или горячим воздухом, или водяным паром, или перегретой водой выше температуры плавления серы. Тогда расплавленная сера отделяется от твердых примесей. Беседой о применении серы заканчивается изучение этого элемента. Чтобы не загромождать память учащихся перечислением всех областей применения свободной серы, можно указать лишь главные из них. К числу таких производств следует отнести: изготовление резины, производство серной кислоты, а также применение серы в борьбе с вредителями садов.
Сероводород и сероводородная кислота
Ввиду того что сероводород не имеет широкого применения и не представляет большого интереса в теоретическом отношении, сведения об этом веществе должны быть по возможности краткими. Учащиеся должны узнать о нем лишь то, что необходимо для характеристики серы как химического элемента, занимающего определенное место в периодической системе.
В подготовке и в проведении уроков на тему "Сероводород и сероводородная кислота" учитель встречается с серьезными затруднениями, связанными с тем, что школьные химические лаборатории не приспособлены для практических занятий с ядовитыми веществами. Но опыт многих учителей показывает; что эти затруднения можно преодолеть, если учитель химии тщательно разработает методику и технику проведения демонстрационных и лабораторных опытов с малыми количествами реактивов.
Для ознакомления с физическими свойствами сероводорода учитель демонстрирует колбу, наполненную сероводородом, обращает внимание учащихся на то, что этот газ бесцветен и легко может быть обнаружен по запаху или при помощи бумажек, пропитанных растворами солей свинца или кадмия. Растворимость сероводорода в воде можно показать так же, как была показана растворимость хлора.
При изучении химических свойств сероводорода следует ознакомить учащихся: а) с кислотными свойствами сероводородной воды; б) с малой термической стойкостью сероводорода; в) с восстановительными свойствами этого вещества.
Чтобы показать кислотные свойства сероводородной воды, следует испытать ее действие на индикаторы и на металлы. С этой целью наливают в две пробирки по 3-4 мл сероводородной воды и приливают в одну из них несколько капель раствора лакмуса (или пробуют лакмусовой бумажкой), а в другую пробирку опускают кусочки магниевой ленты. Сероводородную воду нужно приготовить заранее. Уместно (для сравнения) повторить эти опыты с разбавленной (3-4-процентной) соляной кислотой. Сравнивая скорость реакций между магнием и сероводородной водой и между тем же металлом и соляной кислотой, учащиеся убеждаются, что раствор сероводорода в воде является слабой кислотой.
При изучении реакции окисления сероводорода следует показать учащимся следующий опыт (рис. 72). Через узкую стеклянную трубку, нагреваемую с одного конца и охлаждаемую с другого, пропускают сероводород. Сера (продукт термической диссоциации) осаждается внутри на охлажденной части трубки. Водород и недиссоциированный сероводород у выхода из трубки поджигают.
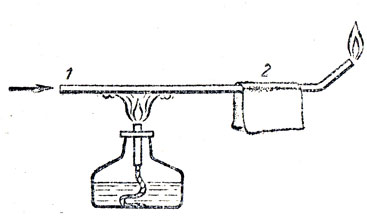
Рис. 72. Разложение сероводорода нагреванием: 1 - трубка, по которой проходит сероводород, 2 - фильтровальная бумага, смоченная водой
Затем можно рассмотреть горение сероводорода в воздухе. Исследуя продукты горения, учитель обнаруживает в них воду и сернистый газ. Воду определяют теми же способами, какими определяли ее в продуктах горения веществ, содержащих водород. О нахождении двуокиси серы судят по запаху продуктов горения сероводорода. На этом основании записывают уравнение реакции:
2H2S+3О2=2H2О+2SО2
Чтобы понять механизм этой реакции, надо изучить пламя горящего сероводорода. Если внести в пламя сероводорода крышечку фарфорового тигля, то можно обнаружить на ней бледно-желтый налет серы. Из этих наблюдений следует вывод, что во внутренней части пламени сероводорода происходит диссоциация этого вещества. А конечные продукты горения сероводорода образуются в наружной части пламени. Анализ процесса горения позволяет предвидеть возможность полного и неполного окисления сероводорода.
Нетрудно также показать, что сера вытесняется из сероводорода и галогенами. Для этого достаточно прилить к сероводородной воде йодную воду. Исчезновение бурой окраски раствора йода и появление коллоидной серы служат признаками реакции. Учащимся можно дать написать уравнение этой окислительно-восстановительной реакции в свете электронных представлений.
Сернистые металлы были известны учащимся еще раньше. Теперь можно рассмотреть сернистые металлы как соли сероводородной кислоты. С этой целью нужно показать несколько реакций обмена, происходящих между сероводородной кислотой и солями тяжелых металлов в растворе.
Перед ознакомлением с лабораторным способом получения сероводорода учитель напоминает учащимся о получении хлористого водорода действием серной кислоты на хлорид натрия, а затем по аналогии разбирает взаимодействие сульфидов с кислотами. Для демонстрации опытов с сероводородом рекомендуется пользоваться аппаратом Киппа или приборчиком, изображенным на рисунке 73. Можно рассказать о применении сероводорода в химической промышленности, в водолечении, а также в научных и учебных лабораториях. Важно отметить, что сероводород является вредным газом для многих производств и особенно для металлургии, так как присутствие даже очень малых количеств серы в стали или в чугуне сильно снижает качество металла. Поэтому газообразное топливо, предназначенное для металлургических печей, тщательно очищается от примесей сероводорода.
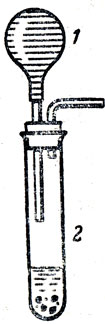
Рис. 73. Прибор для получения малых количеств сероводорода: 1 - резиновой баллончик пипетки, 2 - пробирка с сульфидом железа
Двуокись серы
Изучение двуокиси серы можно вести по плану: свойства двуокиси серы; нахождение ее в природе; применение и получение.
При изучении свойств двуокиси серы рекомендуется еще до начала урока наполнить несколько колб этим газом. Получать его лучше всего действием серной кислоты на сульфит натрия. И только в исключительном случае можно использовать концентрированную серную кислоту с медью. Для проведения этих реакций следует воспользоваться прибором, который применялся для получения хлора. Желательно также выставить на ученические столы по одной пробирке с сернистым газом, плотно закрытой каучуковой пробкой. При рассмотрении физических свойств нужно обратить внимание учащихся на то, что двуокись серы - бесцветный газ. (В VII классе при сжигании серы они наблюдали образование синеватого тумана. Поэтому некоторые учащиеся считают, что двуокись серы синего цвета.) Затем можно предложить учащимся осторожно понюхать сернистый газ, находящийся в пробирках на столах. Хорошую растворимость двуокиси серы легко показать в приборе, которым пользовались при демонстрации опыта растворимости хлора и сероводорода. В этом случае опыт пройдет более эффектно, так как растворимость двуокиси серы почти в 15 раз больше растворимости сероводорода.
Для химической характеристики окислов вообще и двуокиси серы в частности важно установить: является ли данный окисел основным или кислотным; обладает ли он восстановительными или окислительными свойствами и при каких условиях проявляются эти свойства.
Из курса химии VII класса учащимся должно быть известно, что двуокись серы - ангидрид сернистой кислоты. При повторении можно напомнить об этом свойстве, испытать индикатором (лакмусом) раствор его в воде, показать взаимодействие этого окисла со щелочью, пропуская двуокись серы через слабый раствор едкого натра (к которому добавлен спиртовой раствор фенолфталеина). Окислительные и восстановительные свойства двуокиси серы нужно связать с переходом четырехвалентной серы в шестивалентную или в элементарную (с нулевой валентностью). Восстановительные свойства двуокиси серы хорошо проявляются при взаимодействии этого окисла с бромной или йодной водой. При пропускании двуокиси серы в стакан или в цилиндр с бромной (или йодной) водой происходит реакция:
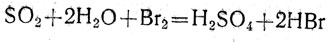
Это уравнение окислительно-восстановительной реакции: бром окисляет четырехвалентную серу до шестивалентной. Учащимся предлагают написать это уравнение так, чтобы его можно было рассмотреть на основе перехода электронов от восстановителя к окислителю.
Для определения окислительных свойств двуокиси серы можно показать взаимодействие двуокиси серы с сероводородом: до начала урока наполняют один цилиндр сернистым газом, другой - сероводородом и накрывают их стеклами, смазанными вазелином. Во время опыта соединяют оба цилиндра отверстиями, вынимают стеклянные пластинки и наблюдают появление серы на влажных стенках цилиндров.
Сопоставляя рассмотренные выше реакции, учитель должен отметить относительность понятий "окислитель" и "восстановитель", так как двуокись серы в одном случае является восстановителем, в другом - окислителем. В заключение химической характеристики двуокиси серы следует ознакомить учащихся с белящими свойствами этого вещества. Хорошим примером является взаимодействие двуокиси серы с раствором фуксина. В большую пробирку или в малый цилиндр наливают немного разбавленного раствора фуксина и пропускают через него двуокись серы до исчезновения окраски. Затем помещают некоторое количество этого бесцветного раствора в стакан или колбочку и нагревают до появления прежней окраски фуксина. В результате реакции получаются бесцветные непрочные вещества, которые при нагревании разлагаются на фуксин и двуокись серы.
Сернистая кислота и ее соли
Ко времени изучения этой темы учащиеся уже знают о составе и свойствах сернистой кислоты. Задача данного урока состоит в уточнении этих знаний и в дополнении их, благодаря этому учащиеся смогут составить химическую характеристику сернистой кислоты.
Она может существовать только в растворах сравнительно малой концентрации, обладает общими свойствами кислот в растворе, особые свойства сернистой кислоты, обусловленные наличием четырехвалентной серы в кислотном остатке, характеризуют эту кислоту как восстановитель (четырехвалентная Сера переходит в шестивалентную).
Так как учащиеся знакомились со свойствами сернистого газа и сернистой кислоты в VII классе, то в домашнюю подготовку к этому уроку следует включить повторение материала о двуокиси серы и о сернистой кислоте. На уроке при проверке знаний свойств сернистого газа учитель уточняет растворимость его в воде.
Зная растворимость сернистого газа в воде (10% по весу или 40 объемов газа на один объем воды), нетрудно подсчитать, что в насыщенном растворе двуокиси серы концентрация сернистой кислоты невелика (примерно одна молекула кислоты на 80 молекул воды), если считать, что вся двуокись серы гидратирована в растворе. Поэтому о физических свойствах сернистой кислоты нельзя говорить, так как ее нельзя получить в свободном состоянии.
Изучение химических свойств кислоты следует начать с тех свойств, которые связаны с наличием в растворе кислоты иона водорода (действие на лакмус, взаимодействие с магнием).
Получить сернистый газ и сернистую кислоту могут сами учащиеся в приборе, которым они пользовались при получении хлористого водорода и соляной кислоты.
Растворимость двуокиси серы в воде. Собрать двуокись серы в пустую пробирку, погрузить ее открытым концом в стакан с водой.
Действие сернистой кислоты на лакмус. К небольшому количеству сернистой кислоты прилить несколько капель раствора лакмуса.
Разложение сернистой кислоты при нагревании. Нагреть полученный в предыдущем опыте розовый раствор и наблюдать изменение окраски лакмуса.
Восстановительные свойства сернистой кислоты. Через раствор брома или йода пропустить сернистый газ и наблюдать обесцвечивание этого раствора.
После выполнения лабораторной работы следует провести заключительную беседу, проверить и уточнить выводы, сделанные учащимися на основании этих опытов и тех знаний, которыми они располагают при их выполнении.
В заключение следует ознакомить учащихся с составом и общими свойствами солей сернистой кислоты. Нужно показать образцы кислых и средних солей, ввести термины "сульфиты" и "бисульфиты" и ознакомить с составом и свойствами их.
Серный ангидрид и серная кислота
В большинстве учебников по химии для средней школы даны небольшие сведения о серном ангидриде; о нем говорится только как о промежуточном продукте в производстве серной кислоты. Вполне естественно, что окончившие среднюю школу имеют смутное представление о серном ангидриде, что неблагоприятно отражается и на усвоении учащимися характеристики серы и принципов получения серной кислоты. Это объясняется тем, что серный ангидрид трудно получить и хранить. Проще и быстрее можно получить серный ангидрид действием фосфорного ангидрида на концентрированную серную кислоту с последующей отгонкой и конденсацией ангидрида.
Ознакомление с физическими свойствами серного ангидрида следует начать с показа образца этого вещества. Цвет и кристаллическую структуру серного ангидрида учащиеся могут увидеть, рассматривая ангидрид в запаянных пробирках, которые могут храниться в лабораториях в течение многих лет.
Затем учитель рассказывает о взаимодействии серного ангидрида с водой, с основаниями, окислами, обращает внимание на экзотермичность этой реакции. Нужно также отметить окислительные свойства серного ангидрида как окисла, в котором сера шестивалентна. На свойствах серного ангидрида следует остановиться в начале урока, основной задачей которого является изучение свойств серной кислоты. Напоминая о физических свойствах серной кислоты, следует сравнить моногидрат с растворами этой кислоты различной концентрации и отметить изменения плотности ее в зависимости от изменения концентрации раствора. О хорошей растворимости в воде серной кислоты учащимся известно из вводного курса. Чтобы показать гигроскопичность концентрированной серной кислоты, надо уравновесить на технохимических весах широкий, но низкий стакан или чашечку с концентрированной серной кислотой и оставить весы в таком положении. Через 5-7 мин достаточно ясно обнаружится, что чашечка станет тяжелее вследствие поглощения влаги из воздуха. Затем следует напомнить о взаимодействии разбавленной серной кислоты с металлами, с основными окислами, с основаниями. При этом можно обратить внимание учащихся на скорость реакции замещения водорода в кислоте (в нормальном растворе).
Новым для учащихся является материал об окислительных, свойствах серной кислоты, которые обнаруживаются при взаимодействии концентрированной серной кислоты с углем, с медью, с некоторыми органическими веществами.
При описании реакции концентрированной серной кислоты с медью в учебниках обычно рассматривают ее по стадиям: образование окиси меди (окисление меди серной кислотой) и взаимодействие ее как основного окисла с кислотой, в результате чего образуется сульфат меди. Учащиеся предполагают, что окислителем является кислород серной кислоты. В действительности же окислителем в данной реакции является сера (S6+), которая принимает электроны от атомов меди.
Переход электронов можно выразить при помощи стрелки:
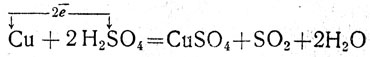
Учитель обращает внимание учащихся на то, что два электрона принимает сера только одной молекулы серной кислоты, за счет чего образуется сернистый газ, а от другой молекулы серной кислоты анион с катионом дает сульфат меди. Учащимся предлагают написать уравнение реакции концентрированной серной кислоты с углем и разобрать его в свете электронных представлений. После этого можно показать действие концентрированной серной кислоты на органические вещества: сахар, бумагу, хлопчатобумажные и шерстяные ткани и др.
Очень эффектен и нагляден опыт окисления серной кислотой сахара. Часто взаимодействие этих веществ объясняется только дегидратацией углевода. Такое объяснение страдает механистичностью: углеводы рассматриваются как гидраты углерода, а при реакции их с серной кислотой не учитываются окислительные свойства ее. При действии же концентрированной серной кислоты на сахар (и другие углеводы) можно в продуктах реакции обнаружить сернистый газ, углекислый газ, воду, уголь и другие вещества. Выделением газообразных продуктов объясняется вспучивание темной массы, образовавшейся от действия серной кислоты на сахар. Опыт лучше всего провести в широкой пробирке или в узком химическом стаканчике. Для этого всыпать в пробирку пять частей (по объему) истертого в пудру сахара, смочить его водой (одна часть), а затем прилить четыре части концентрированной кислоты и быстро размещать стеклянной палочкой.
Обобщая результаты наблюдений этих окислительно-восстановительных реакций, учитель обращает внимание учащихся на то, что одним из продуктов реакции является двуокись серы, при образовании которой валентность серы снизилась с шести до четырех. Можно сообщить, что восстановление четырехвалентной серы может идти дальше, тогда продуктами реакций могут быть сера и сероводород. Этим объясняется присутствие сероводорода в качестве примеси к водороду при действии серной кислоты на цинк, магний и другие металлы.
Для ознакомления учащихся с реакцией на сульфат-ион рекомендуется провести лабораторное занятие, на котором учащиеся получат нерастворимый осадок сульфата бария при действии раствора бариевой соли на растворы серной кислоты и ее солей.
Чтобы закрепить знания и умения учащихся, полученные на этих занятиях, следует предложить им задачи такого содержания: а) найти серную кислоту среди других кислот; б) найти растворы солей серной кислоты среди растворов других солей; в) найти серную кислоту среди растворов других веществ.
В процессе этой работы учащиеся приобретают умения распознавать серную кислоту и растворы ее солей среди растворов других кислот и их солей.
Применение серной кислоты. В некоторых учебниках по химии и химической технологии применение серной кислоты иллюстрируется сложными схемами, в которых указывается большое количество крупных и мелких потребителей этого вещества. Просмотр таких схем занимает много времени и загружает память учащихся фактами, образовательная ценность которых невелика. Эти схемы можно показать для того, чтобы у учащихся сложилось общее представление о проникновении серной кислоты чуть ли не во все отрасли народного хозяйства. Основное же содержание беседы должно концентрироваться вокруг небольшого количества важнейших производств. При этом нужно показать, благодаря каким свойствам серной кислоты она применяется в данном производстве. Поэтому эти беседы должны включать повторение сведений о свойствах серной кислоты, например благодаря высокой температуре кипения и относительной термической стойкости серную кислоту применяют для получения соляной кислоты, с производством которой учащиеся уже знакомы. Необходимо отметить, что таким же способом (действием серной кислоты на соответствующие соли) можно получить и другие кислоты, в частности азотную, так как температура кипения ее ниже температуры кипения серной кислоты. Как пример использования серной кислоты для получения солей следует рассмотреть производство минеральных удобрений - сульфата аммония и суперфосфата и таких солей, как купоросы и квасцы.
Следует также указать на применение серной кислоты для очистки нефтепродуктов, основанной на том, что серная кислота не действует на углеводороды, но разрушает некоторые органические вещества, являющиеся нежелательными примесями.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'