
Скорость химических реакций
Формирование понятия о скорости химических реакции представляет значительные трудности в условиях обучения химии в средней школе. Объясняется это особенностью самого понятия, отличающегося от понятия скорости, которым учащиеся пользовались при изучении механики. Если учитель химии остановится при изучении скорости химической реакции только на качественной ее стороне, то в этом случае учащиеся получат понятие о химической реакции, далекое от состояния современной химической науки. Химическая кинетика (учение о скорости химических реакций) рассматривает в первую очередь скорость реакций с количественной стороны. Для этого вводится понятие б константе скорости химической реакции. Прежде чем перейти к изучению количественного понятия о скорости химической реакции, необходимо с учащимися кратко повторить, что им известно из физики о скорости движения тел. При этом выясняется, что скорость выражают отношением отрезка пройденного пути ко времени (обычно в секундах). Затем ставят вопрос о том, нельзя ли это перенести на скорость химических реакций? Учащиеся обычно легко находят ответ на вторую часть вопроса - скорость реакции можно определять во времени. Но что поставить вместо пройденного пути? Учитель подводит их к тому, что этот пройденный путь в химии понимают как изменение концентрации реагирующих веществ в молях на литр (в учебнике хорошо показан вывод формулы скорости химической реакции). Следовательно, размерность скорости химической реакции - изменение концентрации реагирующих веществ в молях в одном литре в секунду, т. е. моль/л·сек.
Главное, на что должен обратить внимание учитель при изучении скорости химических реакций, заключается в том, что надо выяснить факторы, от которых зависит скорость химических реакций: а) природа химических свойств элементов и веществ, вступающих в химическое взаимодействие; б) концентрация реагирующих веществ; в) температура; г) катализаторы.
Зависимость скорости от природы реагирующих веществ рассматривается на примерах, хорошо известных учащимся. Они знают, что многие вещества реагируют быстро, со взрывом, например водород и хлор, водород и кислород. Надо обратить внимание учащихся также на то, что на скорость химических реакций влияет не одно вещество, а все реагирующие вещества. Так, водород (в отличие от кислорода) реагирует с серой более спокойно, без взрыва; кислород медленно взаимодействует со многими металлами, например с, железом; металлы без взрыва реагируют с хлором и т. д. Обращается внимание на то, что наблюдаются случаи, когда химические реакции протекают медленно, в течение многих лет. Учащимся хорошо известны такие металлы, как медь, железо и др. Из них изготовляют различные бытовые предметы, при пользовании которыми не наблюдается видимых изменений.
Учитель останавливается на природе веществ, которая влияет на скорость химических реакций, и рассматривает это на основе теории строения вещества и теории электролитической диссоциации, например; щелочные металлы реагируют с водой активно, а железо только при высоких температурах. Это можно объяснить строением атомов металлов. Учащимся известно понятие "сила кислот", они знают, что в зависимости от степени электролитической диссоциации скорость реакции одного и того же металла с различными кислотами неодинаковая. При изучении еще одного фактора, влияющего на скорость химических реакций, - концентрации реагирующих веществ учащиеся должны узнать, что при увеличении концентрации молекулы и атомы чаще сталкиваются, поэтому увеличивается вероятность взаимодействия между реагирующими веществами. Для экспериментального изучения скорости химической реакции и влияния на нее различных условий можно использовать следующий прибор (рис. 74). Два одинаковых медицинских шприца объемом по 20 мл закрепляют на фанерной доске, которую ставят на деревянную подставку или зажимают в лапках металлического штатива. Между шприцами наклеивают белый лист бумаги с темными полосами (условные деления, отмеченные цифрами). На верхние части поршней прикрепляют черного цвета стрелки-указатели, сделанные из плотной бумаги или картона. Кончики шприцев вставляют в резиновые пробки, которыми закрывают пробирки для проведения химических реакций.
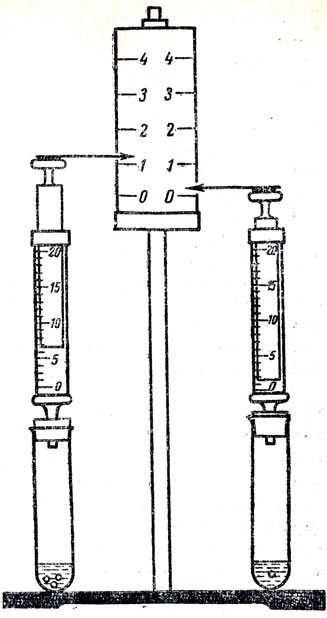
Рис. 74. Прибор для изучения скорости химических реакций
В данном приборе можно провести следующие опыты:
Влияние концентрации реагирующих веществ на скорость химической реакции. В обе пробирки кладут по 3-4 одинаковых кусочка цинка и наливают равные объемы растворов серной кислоты разной концентрации (в одну пробирку 1:5, а в другую - 1:10). Обе пробирки вставляют в пробки прибора. В пробирке с более концентрированным раствором серной кислоты (1:5) отмечается большая скорость выделения водорода (это видно по поднятию поршней, к которым прикреплены стрелки), чем в пробирке с меньшей концентрацией кислоты.
Влияние поверхности реагирующих веществ. В обе пробирки наливают одинаковые растворы серной кислоты (1:5). Пробирки соединяют со шприцами при помощи длинных резиновых трубок и устанавливают их почти горизонтально. В одну пробирку кладут 1-2 кусочка цинка, а в другую столько же по весу цинкового порошка. Пробирки ставят в вертикальное положение, тогда металл попадает в раствор кислоты. В пробирке с порошком наблюдается значительно большая скорость выделения водорода. Опыт можно провести с железом и с железным порошком.
Влияние катализаторов на скорость химической реакции. В две сухие пробирки кладут по полграмма бертолетовой соли. В одну из них добавляют немного двуокиси марганца. Обе пробирки одновременно нагревают на одинаковом пламени. В пробирке с добавкой двуокиси марганца кислород выделяется значительно быстрее, чем в пробирке с чистой бертолетовой солью. По окончании опыта можно поднести тлеющие угольки лучинок к концам шприцев, надавить на поршни и убедиться в образовании кислорода.
Влияние температуры на скорость химической реакции. В обе пробирки кладут по 1 г перманганата калия. Одну пробирку нагревают сильно (на большом пламени), а другую слабо (на маленьком пламени). Отмечают более быстрое разложение перманганата калия (выделение кислорода) при более сильном нагревании. Можно провести знакомые учащимся опыты по разложению других веществ, например ОКИСИ ртути, основной углекислой меди и т. д.
Влияние температуры на скорость химической реакции недостаточно рассматривать только в свете увеличения числа столкновений молекул при нагревании или уменьшении этого числа при охлаждении. Учащиеся должны знать, что не при всяком столкновении молекул наступает химическое взаимодействие между ними. В реакцию вступают так называемые активные молекулы с ослабленной, расшатанной химической связью. Поэтому при повышенной температуре увеличивается число активных, неустойчивых молекул.
При изучении скорости химических реакций следует обобщить знания учащихся о катализе, вспомнить, Как влияет на скорость разложения бертолетовой соли добавление двуокиси марганца. Повторяя этот материал, учащиеся сопоставляют различные факты, известные им, поэтому данный вопрос они могут решить самостоятельно по учебнику.
В школе не изучают закон действия масс, но в связи с введением понятия о константе скорости этот закон приходится давать в скрытой форме. Скорость химической реакции можно практически определять по изменению концентрации реагирующих веществ в единицу времени. Обычно концентрацию выражают числом молей в литре. В этом случае можно определить, сколько молей прореагировало в единицу времени, и сообщить учащимся, что ученые установили такую закономерность: скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ. Это можно показать на известной учащимся реакции между водородом и парами йода:
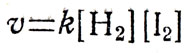
где ν - скорость химической реакции, [ ] условное изображение концентрации реагирующих веществ (в молях на литр), k - константа скорости. Она показывает скорость реакции при концентрации, равной единице, например 1 моль/л. Если в уравнении реакции стоят коэффициенты, то концентрацию вещества возводят в степень с показателем, равным этому коэффициенту, например:
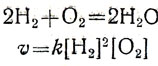
Если эти реакции рассматривать в общем виде, то их можно выразить так:
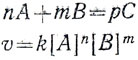
С повышением температуры возрастает скорость реакции, а значит, и константа скорости, например" константа скорости окисления сернистого газа при 400°С - 0,62, при 450°С - 12,00, а при 500°С - 28,50.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'