
Производство серной кислоты
Для ознакомления учащихся с производством серной кислоты важно применять такую последовательность и такие методы изучения технологического процесса, которые наиболее отвечают задачам политехнического (а не технологического) образования и развития мышления учащихся. Чтобы выполнить эти требования, оказывается необязательным рассматривать производство серной кислоты в порядке продвижения сырья и продукции на заводе, т. е. начиная с обжига колчедана, следуя далее по направлению газообразных продуктов и заканчивать рассмотрением процесса абсорбции.
Подобно тому как при изучении веществ ведущим звеном является изучение свойств, позволяющее более осознанно воспринимать и другие сведения об изучаемом веществе, так и при изучении производства нужно исходить из основного процесса, определяющего характер предшествующих и последующих процессов. Таким процессом является окисление сернистого ангидрида в серный ангидрид. Поэтому изучение производства серной кислоты нужно начинать с окисления двуокиси серы. Так как программой предусмотрен только контактный способ производства серной кислоты, то необходимо и достаточно рассмотреть окисление двуокиси серы кислородом в присутствии катализатора. При этом важно выявить следующие условия: а) чистоту газовой смеси (отсутствие влаги, пыли, контактных ядов); б) оптимальную температуру; в) устойчивый и недорогой катализатор. При изучении основных химических производств в школе важнейшими, вопросами являются: 1) что изучать в данном производстве, 2) как изучать это производство. Так как в основе химического производства лежат химические реакции, то их и следует изучать в первую очередь. Эти реакции проводят с целью получения химического продукта в соответствии с определенным государственным стандартом, поэтому учащиеся прежде всего должны ознакомиться с оптимальными условиями течения химических реакций, т. е. с получением хороших технических и экономических показателей химического производства. Для этого надо знать оптимизацию управления химическим производством, т. е. изысканной поддержание оптимальных условий химических реакций в ходе производства. При выборе: оптимальных условий надо исходить из определенной физико-химической характеристики, от которой в первую очередь зависит выход продукта и скорость химической реакции. Для этого нужно выяснить следующие условия:
1. Обратима или необратима химическая реакция изучаемого производства.
2. Экзотермична или эндотермична реакция, что важно знать для изучения равновесия и условий его смещения, поддержания оптимальной температуры.
3. Является ли изучаемая реакция гомогенной или гетерогенной (в связи с этим учащиеся должны знать, следует ли увеличивать поверхность реагирующих веществ, использовать принцип противотока).
4. Протекает ли данная реакция с катализаторами или без них. При выборе методов изучения производства серной кислоты надо знать, что учащиеся должны не просто запомнить закономерности изучаемого производства, а проявить максимум активной самостоятельности с использованием исследовательских методов, когда производственный процесс оказывается перед глазами учащихся не как готовое решение, а как поиск, в результате которого находится это решение. Приводим методику изучения производства серной кислоты контактным способом, разработанную проф. Д. А. Эпштейном. Для этого рассмотрим две важнейших стадии этого производства - окисление сернистого газа в серный ангидрид и получение сернистого газа. Необходимо повторить, что уже известно, учащимся о реакции окисления сернистого газа (обратимая, экзотермическая, каталитическая). Для закрепления знаний об условиях протекания этой реакции демонстрируют следующий опыт.
В небольшую колбу наливают немного концентрированного раствора сернистой кислоты (рис. 75). В колбу вставляют пробку с двумя трубками. Одна из них соединена с резиновой грушей для нагнетания воздуха (ее можно заменить газометром), а другая - со стеклянной трубкой, в которой находится катализатор - свежеприготовленная окись хрома или двуокись марганца. В начале опыта пропускают воздух через раствор сернистой кислоты, образующаяся смесь, содержащая, помимо воздуха, сернистый газ, проходит над катализатором. Учащиеся убеждаются в том, что без нагревания катализатора окисление сернистого газа не происходит. Затем сильно нагревают катализатор и снова пропускают воздух через колбу с раствором сернистой кислоты. Сернистый газ окисляется кислородом воздуха: в колбу с водой проходит серный ангидрид. Над водой образуется густой туман, состоящий из капелек серной кислоты. Серную кислоту обнаруживают при помощи раствора хлорида бария. Данный опыт показывает не только образование серной кислоты, но и то, что серный ангидрид плохо поглощается водой. При изучении производства серной кислоты ссылаются на этот опыт для объяснения того, что серный ангидрид поглощают не водой, а концентрированной серной кислотой. На основе эксперимента учащиеся убеждаются также в важности выбора Температуры и катализатора. Какая же температура поддерживается при окислении сернистого газа на производстве? Учитель сообщает, что практически равновесие почти полностью смещается в сторону образования серного ангидрида при 450-500° С. Отсюда учащиеся делают вывод, что это оптимальная температура. Но учитель предупреждает их о поспешности вывода. Для полного заключения о температурном режиме следует более подробно изучить реакцию окисления сернистого газа, тщательно рассмотреть катализаторы этой реакции.
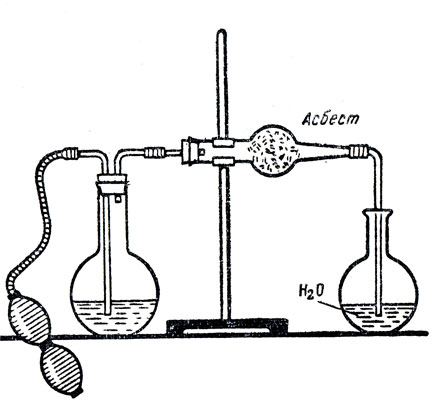
Рис. 75. Получение серной кислоты
Учитель спрашивает учащихся, какие требования должны предъявляться к катализаторам, и совместно с ними выясняет, что при участии катализатора химическая реакция должна протекать быстро, он должен продолжительно действовать и быть активным, доступным и дешевым. С этих позиций и рассматриваются катализаторы: очень активный катализатор платина (но она дорога!), окись железа малоактивна, катализатор на основе пятиокиси ванадия активный, сравнительно дешевый, длительно работает. Учащиеся выбирают катализатор на основе пятиокиси ванадия. Теперь снова возвращаются к оптимальной температуре. На ванадиевом катализаторе скорость окисления сернистого газа становится заметной при 400°С, она велика (около 600°С), но при этом меняется структура катализатора и активность его быстро падает. Какой же будет оптимальная температура? Обычно учащиеся предлагают компромиссное решение - 500°С. Но при этой температуре скорость реакции невелика и производительность контактного аппарата недостаточна. Учитель дает верное решение: реакцию начинают при высокой температуре (600°С), чтобы она шла быстро, а затем постепенно снижают ее до 400-500°С, чтобы на выходе газов из слоя катализатора сместить химическое равновесие в сторону большего образования серного ангидрида. Так как эта реакция гетерогенная, то что надо сделать для большего контакта газов с катализатором? Учащиеся отвечают, что катализатор должен быть в виде зерен. Учитель отмечает подробности в использовании катализатора. Как же регулировать температуру и использовать излишнюю теплоту? Учитель рассказывает о теплообменнике, показывает модель контактного аппарата.
Оптимизация управления процессом получения сернистого газа. Сначала учитель ставит вопрос о сырье, из которого получают сернистый газ. Учащиеся вспоминают о минералах, содержащих серу (сульфиды металлов, самородная сера и т. д.). Какой же из этих источников является лучшим сырьем для получения сернистого газа? Обычно учащиеся отвечают, что это самородная сера. Но это не совсем так. При выборе сырья надо исходить из того, что должны быть большие источники его. Поэтому в первую очередь используют серный колчедан, газы, получаемые при обжиге сульфидных руд для производства цветных металлов, сероводород, получаемый при очистке природного и коксового газов. Так как у нас наиболее распространенное сырье серный колчедан, то учащиеся вспоминают лабораторный опыт его обжига и указывают условия для повышения скорости этой реакции, которые в отдельности разбирают применительно к промышленности.
Концентрацию каких веществ целесообразно увеличить? Обычно учащиеся предлагают увеличить концентрацию кислорода. Но он дорог, поэтому обжиг ведут в токе воздуха. Учащиеся указывают также, что колчедан надо измельчить. Но если измельчить его сильно, тогда току воздуха трудно пробиться через слой колчедана. Как это преодолеть? Учитель рассказывает об обжиге колчедана в кипящем слое, показывает модель. Наконец рассматривается температурный фактор. Отмечают, что оптимальная температура 800°С, выше которой образуется смесь из сульфидов и окислов железа, она спекается, ввиду чего нарушается структура кипящего слоя, уменьшается площадь соприкосновения твердых веществ с воздухом. Но как поддержать эту температуру и использовать избыточную теплоту? Для этого помещают в печь трубки парового котла. Если через них пропускать воду, то можно регулировать температуру и получать водяной пар. Так как учащимся известно уже, что катализатор отравляется вредными примесями сернистого газа, то для демонстрации электроочистки нужно воспользоваться озонатором. Чтобы опыт был достаточно ярким, следует взять воздух с примесью частиц хлорида аммония или табачного дыма (рис. 76). Сравнивая дым, поступающий в действующий озонатор, с выходящим из него газом, учащиеся видят, что значительная часть твердых частиц осталась в электрофильтре.
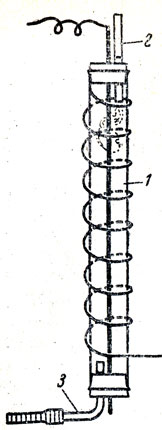
Рис. 76. Использование озонатора в качестве электрофильтра (по К. Я. Парменову): 1 - озонатор, 2 - дымящаяся папироса, 3 - трубка, соединенная с водоструйным насосом или аспиратором
Таким образом, учащиеся подходят к оптимизации управления химических реакций в производстве серной кислоты, исходя из ранее приобретенных знаний. На уроке они самостоятельно активно работают под руководством учителя.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'