
Фосфор
Учебные задачи обучения по теме "Фосфор" состоят: а) в ознакомлении учащихся со свойствами и применением фосфора и его важнейших соединений, имеющих большое значение в промышленности и в сельском хозяйстве; б) в приобретении учащимися умений применять знания периодической системы и электронной теории в изучении веществ, и в частности для составления химической характеристики фосфора как элемента пятой группы периодической системы.
Изучение фосфора, как и других химических элементов, начинается с изучения физических свойств простого вещества. Так как в курсе химии средней школы учащихся знакомят с белым и красным фосфором, то учителю желательно иметь образцы этих веществ, чтобы показать их на уроке. Нужно особо обратить внимание учащихся на одно существенное отличие белого фосфора от красного: первый - сильный яд, второй не ядовит. Следует также отметить различие их физических свойств, и в частности растворимость. Для доказательства того, что белый и красный фосфор, несмотря на различия, являются видоизменением одного и того же элемента, следует рассказать, что красный фосфор можно превратить в белый и наоборот, а также указать на то, что продукты соединения их с кислородом - одно и то же вещество - фосфорный ангидрид.
Превращение небольшого количества красного фосфора в белый можно показать, нагревая в узкой сухой пробирке небольшое количество сухого красного фосфора. При этом белый фосфор возгоняется. Его пары сначала самовозгораются внутри пробирки. Затем, когда весь кислород, находившийся в пробирке, израсходуется, пары фосфора конденсируются, образуя белый налет на стенках пробирки на некотором расстоянии от места нагрева красного фосфора. Если в лаборатории имеются приспособления для затемнения, то можно показать свечение только что полученного белого фосфора и отсутствие свечения у красного фосфора. Для получения более значительных количеств белого фосфора из красного можно воспользоваться прибором, изображенным на рисунке 83. В пробирку 1 помещают красный фосфор и закрывают ее пробкой, через которую проходят две стеклянные трубки. Одна, из них 2 присоединяется к аппарату Киппа, в котором получается углекислый газ. Другая трубка 3, изогнутая под прямым углом, опускается в цилиндр с водой. Опыт начинают с того, что, пропуская через пробирку углекислый газ, вытесняют из нее воздух. Затем уменьшают поступление углекислого газа в пробирку и сильно нагревают ее. Пары фосфора, увлекаемые углекислым газом, поступают в цилиндр с водой, где охлаждаются и превращаются в крупинки белого фосфора.
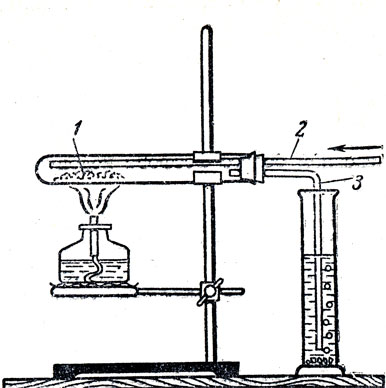
Рис. 83. Превращение красного фосфора в белый: 1 - пробирка с красным фосфором, 2 - трубка, по которой поступает в пробирку углекислый газ, 3 - трубка, по которой пары фосфора с углекислым газом выходят из пробирки
Для сравнения температуры вспышки красного и белого фосфора рекомендуется показать следующий опыт: пластинку из жести укрепляют в лапке штатива (рис. 84). На нее помещают небольшое количество белого и красного фосфора (не больше размера маленькой горошины). Затем нагревают то место пластинки, которое находится между красным фосфором и лапкой штатива. Через некоторое время загорается белый фосфор, находящийся дальше от места нагревания, чем красный. Затем можно поджечь и красный фосфор, чтобы учащиеся увидели, что в результате горения красного и белого фосфора получается одно и то же вещество - фосфорный ангидрид. Таким образом учащиеся познакомятся с важным химическим свойством фосфора - его взаимодействием с кислородом. При этом отмечается валентность фосфора в фосфорном ангидриде. Следует также рассказать об отношении фосфора к водороду и сравнить по этому признаку фосфор с кислородом, азотом, серой и хлором. В заключение можно показать таблицу 17.
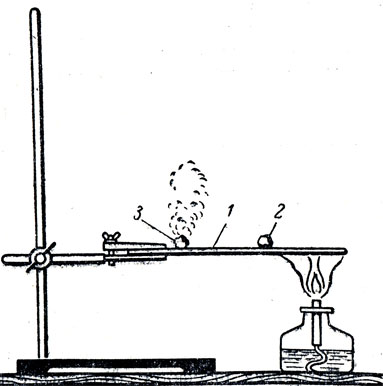
Рис. 84. Сравнение температур воспламенения белого и красного фосфора: 1 - металлически пластинка, 2 - кусочек красного фосфора, 3 - кусочек белого фосфора
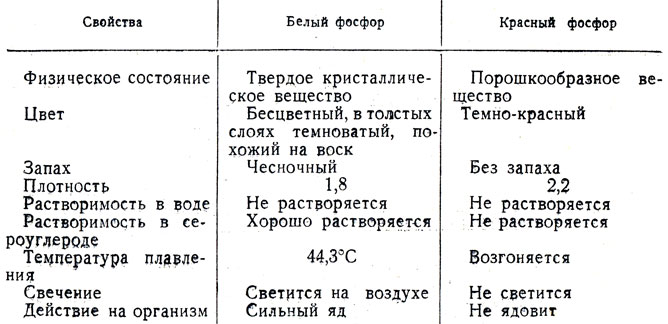
Таблица 17. Свойства белого и красного фосфора
Следует предупредить учащихся о том, что белый фосфор - сильный яд, что ожоги, производимые горящим фосфором, очень болезненны, раны долго не заживают. Лабораторные занятия с применением белого фосфора недопустимы.
Соединения фосфора
Из окислов фосфора рассматривается в средней школе только фосфорный ангидрид. В дополнение к тем сведениям о фосфорном ангидриде, которые получены учащимися в процессе изучения химии в VII классе, следует указать на большую гигроскопичность этого вещества.
На этом свойстве основано применение его для осушки газов и дегидратации некоторых веществ, например для получения в лаборатории серного ангидрида.
Из кислот, содержащих фосфор, достаточно более или менее обстоятельно изучить ортофосфорную кислоту. Желательно показать учащимся образец чистой твердой кислоты, а затем продемонстрировать опыты: действие кислоты на лакмус, реакцию нейтрализации щелочью. Необходимо отметить возможность образования трех видов ионов при электролитической диссоциации этой кислоты и соответственно этому образование трех видов солей: одной средней и двух кислых. Следует также заметить, что ортофосфорная кислота не ядовита.
Из солей ортофосфорной кислоты надо рассмотреть состав и растворимость среднего и кислых фосфатов кальция. Эти сведения необходимы для того, чтобы разъяснить учащимся, зачем обрабатывают трикальцийфосфат кислотами в производстве минеральных удобрений. Интересной реакцией на фосфат-ион является взаимодействие его с ионом серебра, так как этой реакцией можно воспользоваться для обнаружения ортофосфорной кислоты или ее солей в растворе, и поэтому она может быть использована в качественном анализе минеральных удобрений.
Подводя итоги беседы о свойствах фосфора, следует сопоставить строение атомов фосфора, азота, серы, хлора, а также химические свойства этих элементов. В заключительной части урока нужно проверить усвоение следующих знаний учащимися: а) явление аллотропии фосфора; б) отношение его к водороду и к кислороду; в) характер соединений фосфора с водородом и с кислородом; г) валентность фосфора в этих соединениях. При этом нужно сравнить фосфор с его аналогом - азотом и элементами, находящимися с ним в одном ряду, - с серой и хлором.
Фосфор в природе и применение его. После ознакомления учащихся со свойствами фосфора и его соединений им должно быть понятно, почему фосфор не встречается в свободном состоянии в природе. Из соединений фосфора, находящихся в природе, следует указать: а) минеральные вещества и б) органические вещества.
К первым относятся фосфориты и апатиты. Сообщая о важнейших месторождениях этих минералов в СССР, необходимо напомнить учащимся об открытии залежей апатитов на Кольском полуострове и о роли С. М. Кирова и академика А. Е. Ферсмана в организации поисков этих руд. Следует также указать на присутствие фосфора в веществе клеточных ядер животных и растительных организмов. Кости человека и животных, нервные ткани содержат фосфор. Из областей применения свободного фосфора достаточно указать на спичечное производство.
Можно отметить применение фосфорной кислоты для получения медицинских препаратов, кормовых средств и минеральных удобрений. Наибольшее внимание должно быть уделено переработке и использованию солей фосфорной кислоты в производстве минеральных удобрений. Следует рассмотреть применение фосфоритов в виде фосфоритной муки, указать, что только на кислых почвах это удобрение дает хороший результат: Затем нужно напомнить о свойствах однозамещенной кальциевой соли фосфорной кислоты и приступить к краткому описанию получения суперфосфата. Разбирая уравнение реакции, происходящей между трикальцийфосфатом и серной кислотой, необходимо указать на то, что в продуктах этой реакции (суперфосфате) содержится около 50% сульфата кальция, который является балластом. Отсюда возникают задачи, которые должны разрешить химики-технологи: изыскание наиболее дешевых способов удаления этого балласта и полного использования фосфоритов и апатитов. Можно указать и некоторые пути решения этих задач: рассмотреть обработку фосфорита не серной, а фосфорной кислотой, в этом случае получается так называемый "двойной суперфосфат", состоящий в основном из однозамещенной гидросоли кальция и фосфорной кислоты; затем остановиться на обработке фосфорита азотной кислотой. В этом случае продуктом реакции является полноценное азотно-фосфорное удобрение. Следует также сообщить о получении ценного минерального удобрения - аммониевой соли фосфорной кислоты, называемой аммофосом.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'