
Углерод
Положение углерода и кремния в периодической системе. Их свойства. На основе положения углерода и кремния в периодической системе учащиеся могут легко изобразить схемы строения атомов этих элементов и сделать предположения об их свойствах. При изучении физических свойств углерода их следует рассматривать в свете электронного строения вещества, обратив внимание на виды химической связи, расстояния между атомами в кристаллах графита и алмаза. На этой основе следует изучать такие физические свойства, как твердость, электропроводность.
В графите атомы расположены слоями. В каждом слое связь между атомами ковалентная, а между атомами, находящимися в разных слоях, связь металлическая, что и обусловливает теплопроводные свойства графита. Следует подчеркнуть, что нет непроходимой грани между графитом и алмазом. При известных условиях нарушается связь между атомами графита он приобретает новую кристаллическую структуру и превращается в алмаз. В Советском Союзе производят искусственные алмазы, (Действуя на графит высоким давлением (порядка 100000 ат при 2500°С).
При сравнении кремния с углеродом отмечают его больший размер атома, в связи с чем наблюдается ослабление его неметаллических свойств, меньшую прочность ковалентной связи между атомами. В электрическом поле ковалентные связи кремния могут разорваться, поэтому он обладает небольшой электропроводностью.
Ввиду того что в средней школе изучаются органические соединения можно ограничиться на уроке кратким сообщением о том, что существует много соединений углерода с водородом и в этих соединениях углерод четырехвалентен, а химическая связь ковалентная.
Из соединений углерода с металлами более или менее подробно изучается карбид кальция: его свойства (взаимодействие с водой) и получение. В дополнение к этому следует сообщить, что существует много соединений металлов с углеродом (карбидов), среди которых особенно примечателен карбид кальция, Железа, вольфрама. Не вдаваясь в подробности условий получения карбидов, все же нужно отметить, что они резко отличаются от условий образования галогенидов, окислов, сульфидов.
Окись углерода
Ознакомление со свойствами окиси углерода можно провести по общему плану изучения окислов: физические свойства, химические свойства. При изучении физических свойств окиси углерода нужно показать заранее полученную и собранную в цилиндр окись углерода. Для характеристики окиси углерода как кислотного окисла учитель сообщает, что при пропускании этого окисла через расплавленный едкий натр получается муравьинокислый натрий. Следует отметить, что окись углерода непосредственно не соединяется с водой. При ознакомлении учащихся с восстановительными свойствами окиси углерода учитель обращает внимание учащихся на то, что в этом соединении углерод двухвалентен. Это значит, что к атому углерода находящемуся в молекуле окиси углерода, могут еще присоединяться атомы какого-либо элемента, например кислорода, В доказательство этого теоретического вывода учитель может показать горение окиси углерода и доказать, что продуктом этой реакции является углекислый газ, в молекуле которого углерод четырехвалентен. Опыт можно провести, пользуясь прибором, изображенным на рисунке 85. Окись углерода получается действием концентрированной серной кислоты на муравьиную кислоту или муравьинокислый натрий. В первом случае в колбу помещают 20-30 мл муравьиной кислоты, а в капельную воронку - столько же серной кислоты. Взаимодействие серной и муравьиной кислот следует рассматривать как дегидратацию муравьиной кислоты. Этим еще раз доказывается, что окись углерода действительно ангидрид. Ввиду того что окись углерода ядовита, нужно обращаться с ней так же, как и с другими отравляющими веществами, например с хлором. При приливании серной кислоты в колбу и нагревании смеси получающаяся окись углерода проходит через предохранительную пробирку с водой и выходит по трубке, где ее можно поджечь. Предохранительные пробирки вводятся для того, чтобы в случае образования взрывчатой смеси окиси углерода и воздуха в приборе при поджигании взрыв ограничился зоной пробирки. Ярким примером восстановительных свойств окиси углерода может служить восстановление меди из окиси меди. С этой целью к прибору (рис. 85) присоединяют стеклянную трубку, в которой находится окись меди, пропускают окись углерода и нагревают трубку. Окись углерода, не вступившую в реакцию, сжигают при выходе из трубки.
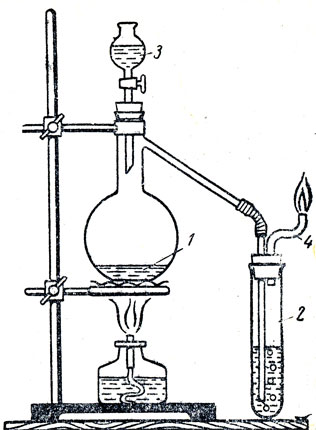
Рис. 85. Получение окиси углерода в лаборатории: 1 - колба с муравьиной кислотой, 2 - предохранительная пробирка, 3 - капельная воронка с серной кислотой, 4 - газоотводная трубка
После разбора этой реакции и записи уравнения рекомендуется решить задачу такого содержания: что должно произойти при нагреваний окиси железа в атмосфере окиси углерода? Для полноты характеристики окиси углерода как ненасыщенного соединения следует сообщить, что к молекуле окиси углерода могут присоединиться два атома хлора. В результате этой реакции получается отравляющее вещество - фосген.
Двуокись углерода
Ввиду того что учащиеся за время изучения химии в IVII классе и естествознания в IV-VI классах получили значительный запас сведений о двуокиси углерода, можно сократить время на изучение свойств этого окисла. Необходимо и достаточно путем опроса повторить то, что учащиеся учили о физических свойствах, растворимости и химических свойствах. При этом можно показать некоторые опыты, например: переливание углекислого газа сифоном из одной склянки в другую (рис. 86); гашение горящих свечей, расположенных на разной высоте в стеклянной банке (рис. 87); гашение пламени бензина, горящего в чашечке, находящейся на дне стеклянной банки (рис. 88). Следует также ознакомить учащихся с устройством и действием огнетушителя.
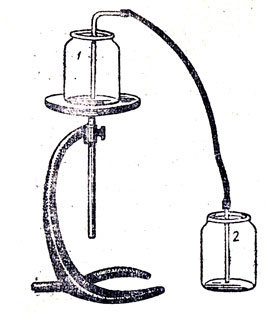
Рис. 86. Переливание углекислого газа сифоном: 1 - банка с углекислым газом, 2 - банка с воздухом
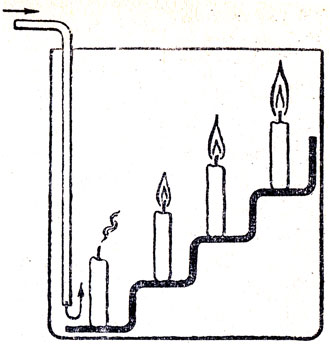
Рис. 87. Гашение свечей углекислым газом
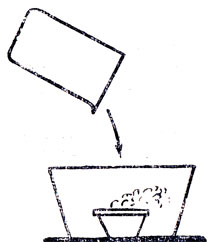
Рис. 88. Гашение пламени бензина углекислым газом
Способы получения углекислого газа в лабораториях известны учащимся. Известен и один из промышленных способов "получения углекислого газа - обжиг известняка. Представляет большой интерес получение углекислого газа из дымовых газов. Этот способ применяется в производстве сухого льда. С ним следует ознакомить учащихся, потому что это производство может служить примером использования и продукта реакции, и тепловой энергии, выделяющейся при горении угля.
Угольная кислота и ее соли
Учебные задачи этого урока состоят в усовершенствовании знаний учащихся об угольной кислоте и ее солях. В результате этого урока учащиеся должны усвоить следующее: а) угольная кислота в свободном состоянии не существует; о составе ее судят по составу солей; б) угольная кислота слабая, существует только в растворе; в) карбонаты термически нестойки; г) карбонаты щелочных металлов растворимы в воде, а карбонаты других металлов в воде нерастворимы; д) при действии кислоты на карбонаты и бикарбонаты выделяется углекислый газ.
Изучая кислотные окислы, учащиеся узнали, что двуокись углерода - ангидрид угольной кислоты. Теперь нужно показать, что гидратация этого окисла является реакцией обратимой. При нагревании разбавленного раствора угольной кислоты она разлагается с выделением углекислого газа. Для этого через водный раствор лакмуса, находящийся в пробирке или конической колбочке, пропускают углекислый газ до перехода фиолетового цвета лакмуса в красный. Затем, закрыв колбочку или пробирку пробкой с газоотводной трубкой, раствор кипятят до перехода красного цвета лакмуса в фиолетовый, при этом газоотводную трубку погружают в известковую воду для обнаружения углекислого газа.
Рассматривая процесс гидратации двуокиси углерода, следует отметить образование гидратированных ионов бикарбоната НСО3- и ионов карбоната СО32-. Отметив малую концентрацию водородных ионов вследствие малой электролитической диссоциации угольной, кислоты, учитель объясняет этим слабую реактивную способность ее. Ознакомление учащихся со ступенчатой электролитической диссоциацией угольной кислоты позволит предвидеть существование средних и кислых солей этой кислоты. При характеристике карбонатов и бикарбонатов важно отметить их взаимодействие с кислотами, термическую нестойкость и различную растворимость в воде в зависимости от катионов этих солей.
Напомнив учащимся о лабораторном способе получения углекислого газа, следует рассмотреть еще раз эту реакцию и отметить ее необратимость вследствие того, что угольная кислота может существовать только в разбавленных растворах и что в условиях опыта двуокись углерода выходит из сферы реакции. По тем же причинам происходит выделение углекислого газа при действии на другие карбонаты и бикарбонаты кислотами. О термической нестойкости карбонатов учащиеся уже имеют некоторое представление на основе изучения разложения известняка. Для ознакомления с растворимостью карбонатов можно воспользоваться таблицей растворимости солей и оснований.
Круговорот углерода в природе
В заключительной беседе по теме "Углерод" рекомендуется рассмотреть круговорот углерода в природе. Так же как и при изучении круговорота азота, сначала, можно рассмотреть кругооборот углерода без участия деятельности человека, а затем указать, какую роль играет в этом процессе человек, изменяющий природу.
Рассматривая процесс усвоения углерода из углекислого тара воздуха, важно отметить роль солнца в синтезе веществ растительного происхождения и значение тех запасов энергии, которые аккумулируются растениями при образовании этих веществ. Отмечая участие человека в этом круговороте, нужно остановиться прежде всего на том, что он пополняет атмосферу углекислым газом, сжигая огромные количества угля, дерева, нефти.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'