
Глава IX. Щелочные и щелочноземельные металлы
Щелочные металлы
Натрий и его соединения
При изучении свойств натрия и его соединений следует принять во внимание, что большая часть сведений, которые даются в учебнике об этих веществах, известна учащимся из курса химии VII класса и эти свойства должны изучаться в порядке повторения. В соответствии с программой первым изучается натрий. Это позволяет при изучении калия пользоваться методом сравнения; таким способом уточняются и закрепляются знания изученного и облегчается усвоение нового материала. По указанным выше соображениям методического характера изучение натрия следует начинать с изучения его физических свойств. Не отрицая значения показа натрия учителем, все же следует предпочесть этому самостоятельную работу учащихся с раздаточным материалом. Поэтому желательно иметь небольшие пробирки, плотно закрытые, с небольшим количеством металлического натрия. Приготовить такие образцы может учитель или лаборант. В небольшую пробирку помещают кусочек натрия, хорошо очищенный от окислов, и наливают столько чистого керосина, чтобы он закрыл весь металл. Затем пробирку нагревают до расплавления натрия. Тогда вводят в эту пробирку другую пробирку, меньшего диаметра, и осторожно нажимают дном этой пробирки на расплавленный натрий. Натрий поднимается со дна по стенкам более широкой пробирки, задерживается на них и затвердевает, образуя зеркальный слой металла. После этого пробирку плотно закрывают корковой пробкой и осторожно заливают менделеевской замазкой.
Легкоплавкость натрия легко показать, расплавив небольшой кусочек под керосином в пробирке. Для демонстрации перехода его в пар (рис. 89) надо в расширенную часть хлоркальциевой трубки поместить небольшой кусочек натрия, очищенный от окислов, и пропустить в трубку водород; затем нагревать натрий до тех пор, пока шарик трубки не заполнится красными парами натрия. При этом учитель сообщает, что пары металлов состоят из одноатомных молекул. Следует также рассказать о плотности натрия и показать его хорошую электропроводность. Изучение химических свойств натрия целесообразно начать с повторного рассмотрения реакций соединения его с кислородом и замещения им водорода в воде.
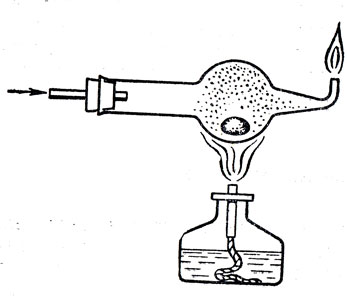
Рис. 89. Переход натрия или калия в парообразное состояние в атмосфере водорода
Обе эти реакции известны учащимся, и рассмотрение их должно проходить в порядке повторения. При составлении уравнения реакции соединения натрия с кислородом (после демонстрации этого опыта) нужно отметить, что в этом случае получается немного окиси натрия Na2О и больше других окислов. Взаимодействие натрия с водой учащиеся наблюдали уже два раза. Теперь достаточно только напомнить об этом и тем закончить химическую характеристику натрия.
Изучение свойств едкого натра тоже должно проходить как повторение. О хлориде натрия следует сказать лишь несколько слов, так как о распространении его в природе и добывании много говорилось учащимся на уроках естествознания, географии и химии.
Так как применение элементов и их соединений следует давать в связи с их свойствами, то учитель отмечает, что применение металла натрия связано с его физическими свойствами: он легкоплавок, кипит при сравнительно высокой температуре и хорошо проводит теплоту. Поэтому его применяют на различных тепловых установках, например на атомных электростанциях. Расплавленный натрий с добавкой некоторого количества калия отнимает теплоту от атомного реактора и передает ее воде (натрий циркулирует по металлическим трубам).
Из всего изложенного видно, что по теме "Натрии" нового материала дается мало, а на повторение пройденного достаточно отвести один урок.
Калий и его соединения
Для изучения свойств калия следует принять тот же план, что и при изучении натрия. При демонстрации взаимодействия калия с водой следует отметить, что этот металл реагирует с водой более бурно; если бросить кусочек калия в стакан с водой, то выделяющийся водород тотчас загорается, что не всегда происходит при аналогичном опыте с натрием.
Особое внимание следует уделить ознакомлению с солями калия как важнейшими минеральными удобрениями. Если в кабинете естествознания проводились опыты для выяснения влияния различных минеральных удобрений на развитие растений, то желательно показать на уроке химии результаты этих опытов на живых объектах.
Учитель знакомит учащихся с добычей сильвинита и его переработкой, отмечает научные заслуги академика Н. С. Курнакова, на основе исследований которого производились изыскания месторождения калийных солей и способы выделения хлорида калия из сильвинита.
Группа щелочных металлов
Для формирования понятия о естественной группе щелочных металлов необходимо в дополнение к тому, что учащиеся узнали о свойствах натрия и калия, сообщить краткие сведения о других металлах этой группы, сопоставив заряды их ядер, атомные массы и свойства. С этой целью нужно назвать эти элементы, сообщить атомные массы, температуры плавления, температуры кипения, плотность и некоторые химические свойства: взаимодействие с кислородом, замещение водорода в воде, формулы их окислов и гидроокисей.
В качестве наглядного пособия следует воспользоваться таблицей, на которой приведены эти данные. На основе анализа таблицы учащиеся под руководством учителя отмечают свойства, общие для всей группы щелочных металлов, а затем констатируют закономерные изменения свойств, если эти элементы расположить в ряд по возрастанию или убыванию их атомных масс. Для того чтобы учащиеся сознательно поняли общие закономерности в свойствах щелочных металлов в связи с возрастанием атомных масс, следует дать самостоятельную работу, при выполнении которой отмечаются сходства и различия изученных элементов: 1) отношение щелочных металлов к воде; 2) отношение их к кислотам (на примере соляной кислоты); 3) отношение к кислороду. При выполнении самостоятельной работы учащиеся составляют уравнения химических реакций, заменяя отдельные химические знаки общим знаком Me, например:
2Ме+2Н2О=2МеОН+Н2
2Ме+2НСl=2МеСl+Н2
Здесь обращается внимание на то, что во всех этих соединениях щелочные металлы одновалентны; молекулы сложных соединений, в состав которых входят атомы щелочных металлов, однотипны по своему строению для каждого класса соединений и сходны по свойствам: МеОН - щелочи, МеСl - соли, Ме20 - окислы. Можно подметить сходство не только в свойствах металлов, но и в химических свойствах их соединений, если дать, например, учащимся написать уравнения реакций между окислами щелочных металлов и водой, подведя эти частные случаи под общую закономерность - образование щелочей:
Me2О+H2О=2MeОH
Но обращая внимание на сходство свойств щелочных металлов и их соединений, не следует забывать и о различиях в свойствах в связи с увеличением заряда их ядер и атомных масс элементов: Для этого надо сопоставить активность взаимодействия щелочных металлов с кислородом, водой и кислотами, отметить закономерность изменений этих свойств.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'