
Щелочноземельные металлы
К числу основных учебно-воспитательных задач преподавания "по данной теме относятся следующие:
1. Более подробно ознакомить учащихся с группой типичных металлов, в которой наиболее ярко выявляются закономерности в изменении свойств и электронной структуры в зависимости от порядкового номера элемента.
2. Научить учащихся пользоваться периодической системой и электронной теорией при изучении химии.
3. Повторить и углубить основы теории электролитической диссоциации.
В программе предусмотрено подробно изучить одного представителя этой группы - кальций и дать некоторые сведения о магнии. Для составления же характеристики группы можно обобщить краткие сведения о строении атомов и свойствах пяти металлов этой группы. При этом можно воспользоваться следующей таблицей:
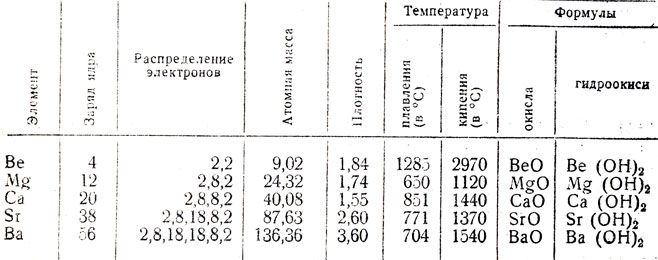
Таблица 19. Свойства элементов главной подгруппы второй группы
Следуя общей схеме ознакомления с химическими элементами, можно рассмотреть положение кальция и магния в периодической системе, строение их атомов, некоторые физические и химические свойства, а также свойства из окислов, и гидроокисей. При этом следует сравнивать строение атомов и свойства щелочных и щелочноземельных металлов, находящихся в одном, к том же ряду периодической системы. Сравнив строение, атомов натрия и магния, калия и кальция, учитель отмечает увеличение числа валентных электронов у атомов щелочноземельных металлов и усиление прочности связи электронов с ядрами атомов, что должно привести к ослаблению химической активности их атомов в отношении к ионам водорода. Для проверки этих предположений можно показать опыт - действие на воду натрия и магния или калия и кальция. Чтобы показать увеличение химической активности в группе щелочноземельных металлов по мере увеличения их атомных масс, нужно сравнить скорость реакции магния и кальция с водой. На основе этих сравнений учащиеся должны убедиться в правильности сделанных ими предположений о том, что с увеличением числа валентных электронов химическая активность металлов, находящихся в одном и том же ряду, уменьшается и что с увеличением числа электронных слоев, атомной массы (атомного номера) активность металлов в одной и той же группе увеличивается.
После этого можно сравнить состав и свойства гидроокисей натрия и магния, калия и кальция и сообщить, что едкие щелочи являются более сильными основаниями, чем гидроокиси щелочноземельных металлов. Сила оснований щелочноземельных металлов увеличивается по мере возрастания атомной массы (или порядкового номера) в этой подгруппе II группы элементов периодической системы.
Важнейшие соединения кальция. Вследствие того что вещества, содержащие кальций, уже изучались в предыдущих классах, урок на эту тему должен быть проведен как повторение. Учащиеся в порядке домашней работы должны подготовиться и на уроке ответить на следующие вопросы:
1. Состав и свойства окиси и гидроокиси кальция.
2. Карбонаты и бикарбонаты кальция, их термическая нестойкость и растворимость в воде.
3. Соли кальция в природе.
4. Производство извести.
При рассмотрении схемы известково-обжигательной печи и процесса обжига известняка следует обратить внимание на непрерывность этого процесса, применение принципа противотока в движении твердых веществ и горячих газов, на возможность использования газообразных продуктов этого производства.
Жесткость воды и способы ее устранения. Учебные задачи этого задания состоят в ознакомлении учащихся с причинами жесткости воды и со способами ее устранения. В водной части к уроку следует напомнить о примесях, растворимых в речной и особенно в колодезной воде, и отметить нахождение ионов кальция и магния в жесткой воде. Чтобы показать характерные признаки жесткой воды, можно предложить учащимся прилить мыльный раствор к воде, не содержащей ионов кальция и магния, а затем добавить туда же раствор, содержащий ионы их. Выпадение осадка нужно объяснить образованием нерастворимых солей стеариновой кислоты и этих металлов. Учащимся сообщалось еще в VII классе, что при нейтрализации стеариновой кислоты едким натром получается стеарат натрия, который был назван мылом. Учащиеся могут написать уравнения реакций обмена между стеаратом натрия и растворами солей кальция и магния. Ознакомившись с тем, что стеараты кальция и магния нерастворимы в воде, учащиеся поймут, почему жесткая вода непригодна для стирки белья, а также и в тех производствах, где используется мыло. Затем следует сообщить, из чего и как образуется накипь в паровых котлах и какие от этого ущербы производству.
Таким образом учащиеся убеждаются в том, что смягчение воды имеет большое хозяйственное значение. При ознакомлении со способами смягчения воды сначала рассматривается способ устранения так называемой временной жесткости, обусловленной наличием бикарбоната кальция в воде. Учащимся уже известна малая стойкость этой соли и условия перехода ее в карбонат. Поэтому им нетрудно понять, на чем основано устранение временной жесткости, - предварительный нагрев в особых котлах и добавление извести к жесткой воде для перевода бикарбоната кальция в карбонат:
Са(НСО3)2+Са(ОН)2=2СаСО3+2Н2О
И в этом и в другом случае ионы кальция уходят из раствора в осадок в составе карбоната кальция.
Для устранения постоянной жесткости, обусловленной присутствием в растворе сульфатов и хлоридов кальция и магния, следует показать взаимодействие концентрированных растворов этих солей с раствором соды. Наблюдая выпадение осадка, учащиеся должны прийти к выводу, что растворимость карбоната кальция меньше, чем сульфата кальция. На этом основании они могут записать уравнение следующей реакции:
CaSО4+Na2CО3=CaCО3+Na2SО4
Таким образом учащиеся познакомятся с реакциями, применяемыми в содово-известковом способе смягчения воды, наиболее широко распространенном в парокотельных установках. Желательно провести экскурсию на предприятие, где осуществляется такой способ устранения жесткости воды. В заключение можно предложить учащимся провести лабораторный опыт приготовления воды с постоянной жесткостью и устранения ее. В настоящее время широко применяется устранение жесткости при помощи катионитов, которые являются сложными соединениями (алюмосиликаты или высокомолекулярные органические соединения), поэтому на данном этапе обучения учитель не может вдаваться в подробности, рассказывая о составе и. строении этих веществ. Дается только общая формула катионитов Na2R, где R - сложный кислотный остаток. Если пропустить через него жесткую воду, то в нем ионы натрия замещаются на ионы магния или кальция, и вода смягчается. Удобство использования такого способа умягчения воды заключается в том, что после пропускания раствора поваренной соли использованный катионит регенерируется (в нем ионы кальция или магния замещаются на ионы натрия, и его можно снова использовать для устранения жесткости воды).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'