
5. Атомная теория и закон простых объемных отношений
Итальянский химик Авогадро (1776 - 1856) уже в 1811 г. предположил, что газы, благодаря большой способности делиться и расширяться, являются веществами, находящимися в молекулярном состоянии, так что при взаимном соединении одна молекула одного газа соединяется с одной молекулой другого газа без остатка. Отсюда Авогадро вывел закон: одинаковые объемы газов содержат, при одинаковых условиях (температуры и давления), одинаковое число молекул. Иначе говоря, один литр водорода содержит такое же количество молекул, как и один литр кислорода, один литр аммиака, один литр водяного пара, вообще как литр любого газообразного вещества, при одинаковых условиях (температуры и давления). См. рис. 3.
Экспериментально было установлено, что:
один литр водорода с одним литром хлора всегда дают два литра хлористого водорода,
два литра водорода с одним литром кислорода всегда дают два литра водяного пара,
три литра водорода с одним литром азота всегда дают два литра аммиака
Таблица 1
Таблица элементов
| Название русское | Название международное | Химический символ | Атомный вес | Атомное число | Валентность |
| Азот | Nitrogenium | N | 14,008 | 7 | III, V |
| Алюминий | Aluminium | Al | 26,98 | 13 | III |
| Аргон | Argon | Ar | 39,944 | 18 | 0 |
| Барий | Barуum | Ba | 137,36 | 56 | II |
| Берилий | Beryllium | Be | 9,013 | 4 | II |
| Бор | Borum | В | 10,82 | 5 | III |
| Бром | Bromum | Br | 79,916 | 35 | I, V |
| Ванадий | Vanadium | V | 50,95 | 23 | II, III, V |
| Висмут | Bismuthum | Bi | 209,00 | 83 | III |
| Водород | Hydrogenium | H | 1,008 | 1 | I |
| Вольфрам | Wolframium | W | 183,92 | 74 | IV, VI |
| Гелий | Helium | He | 4,003 | 2 | 0 |
| Железо | Ferrum | Fe | 55,85 | 26 | II, III |
| Золото | Aurum | Au | 197,0 | 79 | I, III |
| Иод | Jodum | J | 126,91 | 53 | I, V |
| Иридий | Iridium | Ir | 192,2 | 77 | II, III, IV |
| Кадмий | Cadmium | Cd | 112,41 | 48 | II |
| Калий | Kalium | К | 39,10 | 19 | I |
| Кальций | Calcium | Ca | 40,08 | 20 | II |
| Кислород | Oxygenium | О | 16,0000 | 8 | II |
| Кобальт | Cobaltum | Co | 59,84 | 27 | II, III |
| Кремний | Silicium | Si | 28,09 | 14 | IV |
| Криптон | Kryptonum | Kr | 83,80 | 36 | 0 |
| Ксенон | Xenon | Xe | 131,3 | 54 | 0 |
| Литий | Lithium | Li | 6,940 | 3 | I |
| Магний | Magnesium | Mg | 24,32 | 12 | II |
| Марганец | Manganum | Mn | 54,94 | 25 | II, III, IV, VI |
| Медь | Cuprum | Cu | 63,54 | 29 | I, II |
| Молибден | Molybdaenum | Mo | 95,95 | 42 | III, IV, VI |
| Мышьяк | Arsenium | As | 74,91 | 33 | III, V |
| Натрий | Natrium | Na | 22,991 | 11 | I |
| Неон | Neon | Ne | 20,183 | 10 | 0 |
| Никель | Niccolum | Ni | 58,69 | 28 | II, III |
| Олово | Stannum | Sn | 118,70 | 50 | II, IV |
| Осмий | Osmium | Os | 190,2 | 76 | VI, VIII |
| Палладий | Palladium | Pd | 106,7 | 46 | II, III, IV |
| Платина | Platinum | Pt | 195,23 | 78 | II, IV |
| Радий | Radium | Ra | 226,05 | 88 | II |
| Родий | Rhodium | Rh | 102,91 | 45 | II, III, IV |
| Ртуть | Hydrargyrum | Hg | 200,61 | 80 | I, II |
| Рубидий | Rubidium | Rb | 85,48 | 37 | I |
| Свинец | Plumbum | Pb | 207,21 | 82 | II, IV |
| Селен | Selenium | Se | 78,96 | 34 | II, IV, VI |
| Сера | Sulphur | S | 32,066 | 16 | II, IV, VI |
| Серебро | Argentum | Ag | 107,88 | 47 | I |
| Скандий | Scandium | Sc | 44,96 | 21 | III |
| Стронций | Stroncium | Sr | 87,63 | 38 | II |
| Сурьма | Stibium | Sb | 121,76 | 51 | III, V |
| Тантал | Tantalum | Та | 180,95 | 73 | II, III, V |
| Титан | Titanium | Ti | 47,90 | 22 | II, III, IV |
| Торий | Thorium | Th | 232,05 | 90 | IV |
| Углерод | Carboneum | С | 12,011 | 6 | IV |
| Уран | Uranium | U | 238,07 | 92 | IV, VI |
| Фосфор | Phosphorus | Р | 30,975 | 15 | III, V |
| Фтор | Fluorum | F | 19,00 | 9 | I |
| Хлор | Chlorum | Cl | 35,457 | 17 | I, III, V, VII |
| Хром | Chromium | Cr | 52,01 | 24 | II, III, VI |
| Цезий | Caesium | Cs | 132,91 | 55 | I |
| Церий | Cerium | Ce | 140,13 | 58 | III, IV |
| Цинк | Zincum | Zn | 65,38 | 30 | II |
Это действительно и для соединений других газов или веществ в газообразном состоянии (закон простых объемных отношений). Уравнения, действительные для одинакового числа молекул, должны быть действительны и для отдельных молекул, так что согласно атомной теории остается в силе, что:
Н2 + Сl2 = 2 HCl
2 Н2 + О2 = 2 Н2О
3 Н2 + N2 = 2 NH3

Рис. 3. Одинаковые объемы разных газов или веществ в газообразном состоянии содержат одинаковое число молекул (при одинаковых температуре и давлении)
Из этого ясно, что из молекулярных уравнений можно определить объемные отношения, так как каждая молекула в молекулярном уравнении обозначает одну объемную единицу вещества в газообразном состоянии. Следовательно, молекулярное уравнение выражает не только весовые, но и объемные отношения соединенных газов или веществ в газообразном состоянии (рис. 4).
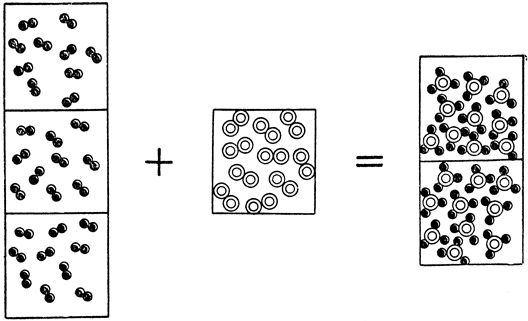
Рис. 4. Схема соединения водорода с азотом (три объема водорода и один объем азота дают два объема аммиака)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'