
6. Применение закона Авогадро. Молярный объем
Так как одинаковые объемы газа содержат одинаковое число молекул, то веса молекул пропорциональны плотности газов.
Плотность газа - это вес одного литра газа при температуре 0°С и давлении 760 мм ртутного столба (плотность кислорода - 1,429). Физическими методами ее можно установить очень точно (особенно если определяется молекулярный вес вещества еще неисследованного) таким способом: при соответствующих давлении и температуре определяется объем, занимаемый определенным весовым количеством испытуемого вещества; температура и давление пересчитываются на 0°С и 760 мм ртутного столба, и по полученному объему и весу вычисляется плотность газа или вещества в газообразном состоянии.
Если известен удельный вес газа или вещества в газообразном состоянии, то можно согласно соотнощению:

вычислить, что молекулярный вес испытуемого вещества:
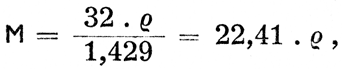
т. е. молекулярный вес газа или вещества в газообразном состоянии равен удельному весу газа или вещества в газообразном состоянии, помноженному на число 22,41.
Ввиду того, что это уравнение действительно во всех случаях, из него вытекает, что грамм-молекула или моль каждого газа, т. е. молярный объем каждого газа
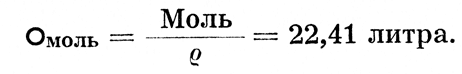
Грамм-молекула или моль каждого газа или вещества в газообразном состоянии занимает при одинаковых температуре и давлении одинаковый объем. При нормальных условиях 0°С и 760 мм давления рт. ст. этот объем составляет 22,41 литра.
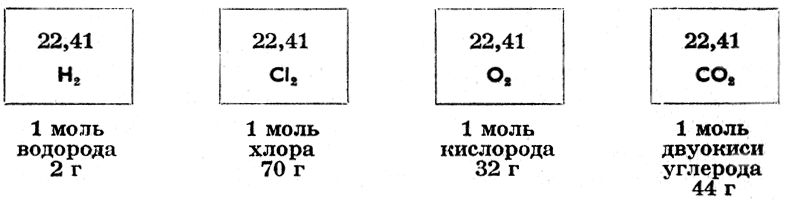
Рис. 5. При нормальных условиях (0°С и давлении 760 мм рт. ст. все газы занимают объем равный 22,41 литра (молярный объем)
На величине молярного объема газа и на молекулярных уравнениях основаны стехиометрические вычисления, в которых веса газов пересчитываются на их объем.
Пример I:
Вычислите, сколько литров кислорода получится разложением 250 г HgO и какой объем кислород будет занимать при нормальных условиях (0°С и 760 мм давления).
Для вычисления нужно воспользоваться молекулярным уравнением, ибо оно указывает отношения объемов:
2 HgO = 2 Hg + О2
2 * 216,16 г = 2 * 200,16 г + 2 * 16 г,
далее
из 432,32 г HgO получится 32 г кислорода (22,41) литра)
из 250 г HgO получится х г кислорода × литров
из соотношения
х : 22,41 = 250 : 432,32
| x = | 250 * 22,41 | = 12,96 литра |
| 432,32 |
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'