
7. Растворение веществ. Растворы
Твердые, жидкие и газообразные системы (смеси) двух или нескольких компонентов, образующих одну фазу (гомогенные), называются растворами. По агрегатному состоянию мы различаем растворы газообразные (газовые смеси), растворы жидкие (растворы газов, жидкостей и твердых веществ в жидкостях) и растворы твердые (сплавы, стекло).
а) Получение растворов.
Общепринятым растворителем является вода, но т. к. не все вещества, особенно не все вещества органические, растворяются в воде, то применяются и другие растворители, например, спирт, эфир, ацетон, бензол, пиридин и т. д. Иногда с успехом применяются также смеси растворителей, напр. смеси спирта с водой. Растворители мы делим на полярные и неполярные.
Для получения раствора мы заставляем обычно плотно соприкасаться те вещества, из которых раствор должен быть приготовлен. Здесь, однако, имеет значение характер растворяемых веществ и растворителя.
Если растворяемое вещество твердое, то прежде всего его следует измельчить (в ступке или в мельнице), чтобы получить как можно большую поверхность для соприкосновения между растворяемым веществом и растворителем. Этим, а также перемешиванием и взбалтыванием значительно ускоряется получение раствора. Иногда на сосуд, в котором приготовляется раствор, мы насаживаем обратный холодильник, особенно в тех случаях, когда раствор приготовляется кипячением. Этим мы уменьшаем потери растворителя, пары которого, образующиеся при нагревании смеси, осаждаются в холодильнике и стекают обратно в смесь (особенно это важно в том случае, когда растворитель горюч и его пары при работе с открытым сосудом могли бы загореться от соприкосновения с отопительным устройством).
Всегда, когда мы говорим о растворе, то подразумеваем раствор в физическом смысле, т. е такой, при образовании которого не произошло никакой химической реакции. Только в этом случае мы можем фракционированием раствора (напр. испарением растворителя) получить растворенное вещество. Напр. раствор хлористого натрия дает при испарении снова хлористый натрий.
Если же растворить напр. Zn в серной кислоте, то обратно мы уже не получим цинк и серную кислоту, а получим иное вещество - сернокислый цинк, который образовался путем химической реакции, т. е. действием серной кислоты на цинк.
Нельзя получать растворы любого состава, т. к. растворимость веществ в определенном растворителе ограничена. Мы вводим здесь следующие понятия растворов: ненасыщенный (разбавленный), насыщенный и пересыщенный. Ненасыщенный (разбавленный) - это такой раствор, в котором можно растворить еще некоторое количество уже растворенного вещества, тогда как у насыщенного раствора дальнейшее растворение вещества невозможно (ввиду того, что растворимость вещества зависит от температуры - необходимо ее указать). Некоторые кристаллические вещества дают пересыщенные растворы (сахар, углекислый натрий, сульфат натрия и т. д.), которые содержат большее количество растворенного вещества, чем то, которое при определенных условиях они могли бы содержать. Так как растворимость большинства веществ зависит от температуры (с повышением температуры растворимость увеличивается), то пересыщенный раствор получается в том случае, если насыщенный при высокой температуре раствор осторожно охладить так, чтобы из него не выделился излишек растворенного вещества.
Растворимость какого-либо вещества определяется количеством граммов этого вещества, способным образовать при определенной температуре насыщенный раствор. Для получения растворов особое значение имеет растворимость веществ при температурах 20°С и 100°С. Эти величины можно найти в таблицах (напр. табл. 9).
Таблица 9
| Вещество | Формула | 20°С | 100°С |
| Бромистый калий | КВr | 65,2 | 104,0 |
| Двухромовокислый калий | К2Сr2O7 | 12,0 | 80,0 |
| Хромовокислый калий | К2СrО4 | 61,7 | 75,6 |
| Хлористый натрий | NaCl | 36,0 | 39,8 |
| Гидроокись кальция | Са(ОН)2 | 0,16 | 0,08 |
| Хлористый цинк | ZnCl2 | 396,0 | 615,0 |
Из таблицы следует, что в 100 г воды при 20°С необходимо растворить 65,2 г бромистого калия, чтобы получить насыщенный (при 20°С) раствор. Далее видно, что растворимость веществ весьма различна и что с повышением температуры она у различных веществ повышается по-разному. У некоторых соединений растворимость падает с повышением температуры [Са(ОН)2].
б) Концентрация растворов.
Концентрацию растворов можно выразить самыми разнообразными способами в зависимости от того, для какой цели нам нужно ее знать.
Самый обыкновенный способ - выражать концентрацию раствора в весовых процентах, т. е. % веса - количеству вещества в граммах, растворенного в 100 г раствора.
Если в растворе на Q граммов растворителя приходится q граммов растворенного вещества, то концентрация с (вес. %) выражается равенством:
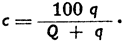
Пример 1: Какова концентрация раствора, содержащего на 140 г растворителя 18 г растворенного вещества?
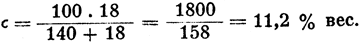
Пример 2: Сколько растворителя нужно прибавить к 600 г 25%-ного раствора какого-либо вещества, чтобы получить 8%-ный раствор?
Если обозначим через q пока неизвестное нам количество растворенного вещества, которое не меняется от разбавления раствора, а х-ом - количество растворителя, которое необходимо прибавить, чтобы получить раствор искомой концентрации, то согласно предыдущему можно написать:
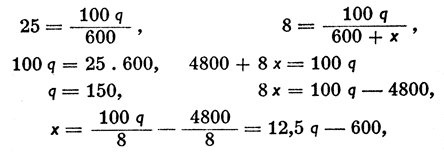
откуда получим, что х = 12,5 * 150 - 600 = 1275 г.
Молярность раствора - это число молей растворенного вещества в одном литре раствора (при 20°С). Молярность обозначается буквой М. Напр. 0,1 М раствора обозначает такой раствор, который содержит 0,1 моля растворенного вещества в 1000 мл раствора.
Пример: Какова молярность раствора серной кислоты, который содержит в 250 мл 22 г серной кислоты?
Если в 250 мл раствора содержится 22 г серной кислоты, то в 1000 мл содержится 22 * 4 = 88 г серной кислоты. Это количество выразим в молях серной кислоты, разделив его на молекулярный вес серной кислоты (H2SО4, т. е. 2 * 1,008 + 32,066 + 4 * 16 = 98,082), т. е. 88 : 98,082 = 0,9. Кислота 0,9-молярная.
Эквимолярные растворы - это растворы одинаковой молярной концентрации. Так напр. раствор, содержащий в одном литре 74,557 г KCl, эквимолярен раствору, содержащему 58,44 г NaCl в одном литре, ибо молекулярный вес KCl = 74,557, а молекулярный вес NaCl = 58,44.
Растворы, концентрация которых выражается числом молей растворенного вещества, содержащихся в 1000 г растворителя, называются, в отличие от растворов молярных, моляльными растворами.
Нормальным раствором называется раствор, содержащий один граммэквивалент растворенного вещества в г в одном литре. Грамм-эквивалент - это моль, отнесенный к водороду. Так напр. NHCI (читать: хлористоводородная кислота) содержит 1 моль HCl = 36,465 г HCl в одном литре. NH2SО4 (читать: нормальная серная кислота) содержит моль: 2 = 98,08 : 2 - 49,04 г серной кислоты в одном литре раствора. 0,1 NH2SО4 (читать: децинормальная серная кислота) содержит 4,904 г H2SО4 в одном литре раствора.
в) Общее количество вещества в растворе.
Если в раствор прибавить растворителя, то увеличится вес раствора, но количество растворенного вещества останется неизменным. Иначе говоря, общее количество вещества в растворе остается постоянным.
Если вес растворенного вещества = q, вес раствора = R, то концентрация раствора 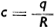 и q = cR. С прибавкой растворителя концентрация раствора становится с1, а вес R1, т. ч. q - c1R1 следовательно cR = с1R1.
и q = cR. С прибавкой растворителя концентрация раствора становится с1, а вес R1, т. ч. q - c1R1 следовательно cR = с1R1.
Произведение концентрации раствора на его количество не меняется от разбавления раствора.
Пример 1: Сколько воды надо прибавить к 360 г 15%-ного раствора хлористого калия, чтобы получить 12%-ный раствор?
Общее количество вещества в растворе перед разбавлением его будет равняться общему количеству вещества в растворе после разбавления, так что, если прибавку воды назвать х, то получим уравнение:
300 * 15 = (360 + х) 12,
5400 + 4320 + 12 х
х = 90 г воды.
Этот пример можно решить еще при помощи так наз. правила смешения; порядок решения следующий:

Пример 2: 450 г 35%-ного натрового щелока (NaOH) надо разбавить в 20%-ный раствор. Сколько 15%-ного раствора натрового щелока необходимо прибавить? - Количество необходимого 15%-го раствора назовем х, тогда получаем уравнение:

9000 + 20 х = 15 750 + 15 х,
5 х = 6 750,
х = 1 350 г 15%-ного раствора.
Решение при помощи правила смешения:
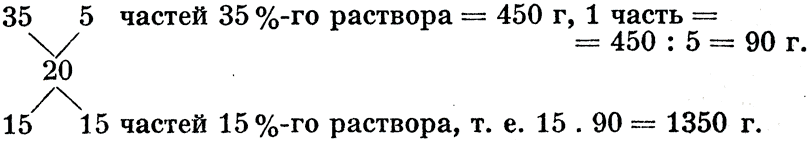
Пример 3: Сколько чистого хлористого натрия нужно прибавить к 2500 г 15%-го раствора хлористого натрия, чтобы получить 20 %-ный раствор? Если обозначим через х количество прибавленного 100%-ного раствора хлористого натрия, то получим уравнение:
(2 500 + х) 20 - 2500 * 15 + 100 х,
50 000 + 20 х = 37 500 + 100 х,
80 х = 12 500,
х = 1250 : 8 = 156,25 г хлористого натрия.
Решение правилом смешения:

г) Кристаллизация растворов.
Если оставить раствор поваренной соли в открытом сосуде в теплом месте, то вода будет постепенно испаряться и из раствора начнут выделяться геометрические фигуры правильной формы, называемые кристаллами поваренной соли. Этим, так наз. способом кристаллизации испарением, или свободной кристаллизации, добывается соль из морской воды. Свободной кристаллизацией пользуются в тех случаях, когда проводится кристаллизация веществ, растворимость которых не изменяется значительно с изменением температуры. Кристаллы получаются большие; они содержат некоторое количество загрязнений из маточного раствора, т. е. из оставшегося раствора.
Для кристаллизации веществ, растворимость которых возрастает с повышением температуры, применяется способ кристаллизации охлаждением или принудительной кристаллизации. Приготовим насыщенный при высокой температуре раствор, быстро его профильтруем и охладим. При этом выделятся небольшие, очень чистые кристаллы, количество которых зависит от разности растворимости вещества при низкой и при высокой температуре.
Некоторые вещества дают пересыщенные растворы, которые часто даже при охлаждении не кристаллизуются. В таких случаях мы вызываем кристаллизацию встряхиванием или трением палочки о стенки сосуда, но лучше всего так наз. заводкой, т. е. прибавлением небольшого кристаллика растворенного вещества.
Кристаллы представляют собою геометрические формации, ограниченные правильными геометрическими плоскостями, образующими вполне определенные углы (как у больших, так и маленьких кристаллов углы эти одинаковы); это указывает на правильность их внутренней структуры.
Некоторые вещества, напр. хлористый натрий (NaCl) а азотнокислое серебро (AgNO3) выделяются из растворов безводными; другие же - содержат некоторое количество воды, которая участвовала в их образовании. Эта кристаллизационная вода и соли, которые кристаллизуются с ней, называются гидратами. Напр. при кристаллизации соды (углекислого натрия) при нормальной температуре (точно до 32°С) сода кристаллизируется с 10 молекулами воды:
Na2CO3 * 10 Н2О (десятиводный). В пределах 32 - 35,5°С постоянным будет Na2CО3 * 7 Н2O (семиводный), тогда как при температурах от 35,3 до 107°С выделяется Na2CO3 * Н2О (многоводный), который при 107°С переходит в безводную соду (Na2CО3).
е) Сокращение объема. Азеотропия.
Некоторые жидкости совершенно не смешиваются друг с другом (ртуть и вода), некоторые смешиваются в любых соотношениях (спирт и вода), есть и такие, которые смешиваются только в определенных отношениях (если взболтать эфир с водой, а затем оставить на некоторое время в покое, то насыщенный раствор воды в эфире поднимется наверх, а внизу осядет насыщенный раствор эфира в воде). Жидкости неполярные (углеводороды, сероуглерод и бром) легко перемешиваются с неполярными же и, наоборот, жидкости полярные (вода и спирт) легко перемешиваются с жидкостями полярными же. Неполярные соединения, как правило, не смешиваются с полярными (сероуглерод и вода).
При получении некоторых растворов смешивающихся жидкостей происходит так наз. сокращение объема, т. е объем раствора будет меньше объема суммы обоих смешиваемых жидкостей. Напр., если смешать 50 мл спирта и 50 мл воды, то получится 96,3 мл раствора вместо ожидаемых 100 мл. Сокращение объема объясняется взаимодействием обоих компонентов (напр. образованием гидратов) и встречается очень часто при разбавлении концентрированных кислот.
Если мы нагреваем смесь жидкостей, то образующиеся пары содержат пары обоих жидкостей. По закону Дальтона их упругость равняется сумме парциальных упругостей обоих составных частей. У несмешивающихся жидкостей парциальные давления выделяющихся паров такие же, как у чистых жидкостей в смеси, так что точка кипения смеси ниже точки кипения обоих составных частей. Напр., эфирное масло (имеющее точку кипения выше 100°C образует с водой смесь, которая перегоняется при температуре ниже 100°С. Этим способом перегоняются соединения с высокой точкой кипения, или же такие вещества, которые разлагаются при высокой температуре. Такой процесс называется перегонкой с водяным паром. Иногда пользуются и перегретым паром. У смешивающихся жидкостей парциальные упругости выделяющихся паров ниже упругостей паров чистых жидкостей. При перегонке некоторых смесей смешивающихся жидкостей нельзя говорить о постоянной точке кипения. Эта точка повышается, пока не отгонится компонент с более низкой точкой кипения, и температура не дойдет до точки кипения компонента с более высокой точкой кипения. Некоторые смеси смешивающихся жидкостей имеют при определенной концентрации постоянную точку кипения. Такие смеси называются азеотропными. При кипячении азеотропных смесей выделяется пар, который имеет те же компоненты, как и азеотропная смесь. Поэтому смеси некоторых смешивающихся жидкостей нельзя разделить на составные части перегонкой. Так напр. этиловый спирт с водой образует азеотропную смесь, которая содержит 95,57 вес. % этилового спирта и ее точка кипения = 78,2°С. Если нужно приготовить 100%-ный этиловый спирт (абсолютный), необходимо удалить из него воду. Это делается химическим путем (гашеной известью), или прибавлением к 95%-ному этиловому спирту бензола и затем перегонкой этой смеси. При 64,8 °С перегоняется смесь этилового спирта + вода + бензол, которая содержит всю воду этилового спирта. Затем отгоняется бензол вместе с небольшим количеством этилового спирта и остается абсолютный спирт.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'