
Обобщенный формализм метода ВС как реализация идей Гайтлераг Лондона, Румера и Вейля
Обратимся теперь к рассмотрению метода ВС в его современной формулировке. При этом мы будем пользоваться некоторыми понятиями и концепциями, анализ исторического развития которых будет дан ниже. В этом отношении изложение будет иметь отчасти ретроспективный характер, что позволит нам, с одной стороны, четче выявить основное позитивное содержание работ Гайтлера, Лондона, Румера, Вейля и других авторов, а с другой - установить связь между рассмотренной выше формальной химико-алгебраической аналогией и основными понятиями теории спин-валентности, т. е. связать с ней ее "математическую предысторию". Наиболее важным, однако, является то, что в свете излагаемой здесь общей теории станет более ясной взаимосвязь обсуждаемых концепций гибридизации и резонанса, которые исторически возникли независимо друг от друга. А это, в свою очередь, позволит лучше понять внутреннюю логику развития квантовой химии.
Как мы видели выше, основная идея метода ВС заключается в предположении, что атомы или, точнее, атомные орбитали при образовании молекулы в значительной степени сохраняют свою индивидуальность. Из орбиталей отдельных атомов A, Б, ..., находящихся на конечном расстоянии друг от друга, но условно считающихся невзаимодействующими, строится многоэлектронная бесспиновая функция-произведение
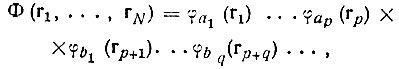 (3.31)
(3.31)
где 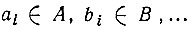 и т. п. При этом φа1,...,φаp могут быть (в общем случае) не сферическими орбиталями изолированного атома, а их линейными комбинациями, т. е. гибридными атомными орбиталями.
и т. п. При этом φа1,...,φаp могут быть (в общем случае) не сферическими орбиталями изолированного атома, а их линейными комбинациями, т. е. гибридными атомными орбиталями.
Совокупность всех орбиталей ф называется в методе ВС конфигурацией, а каждый из наборов (φа1,...,φаp)- валентной конфигурацией ГA атома A. Некоторые из атомных орбиталей входят в ГА дважды (т. е. φаi = φаj) и называются спаренными. Число неспаренных орбиталей в конфигурации ГА называется спин-валентностью атома A, находящегося в соответствующем валентном состоянии. Это определение спин-валентности является обобщением, данным Лондоном. Действительно, если пренебречь гибридизацией атомных орбиталей, то оба определения станут идентичными, т. е. спин-валентность окажется равной мультиплетности основного (низшего) терма, уменьшенной на единицу.
Функция Φ домножается на функцию Θ(σ1,...,σN), зависящую от спиновых переменных всех электронов. Многоэлектронная функция Ψ, определяющая электронное состояние молекулы, должна быть собственной для оператора квадрата полного спинового момента 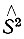 N-электронной системы, которую представляет молекула. Так как
N-электронной системы, которую представляет молекула. Так как 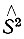 действует только на функцию Θ указанное условиt накладывает определенные ограничения только на Θ, но не на Φ.
действует только на функцию Θ указанное условиt накладывает определенные ограничения только на Θ, но не на Φ.
Подавляющее число веществ, способных к длительному существованию, состоит из молекул с нулевым полным спином, т. е. находится в синглетном состоянии. Для простоты изложения в дальнейшем будут рассматриваться только такие молекулы.
Каждой атомной орбитали φ соответствует одна из двух одноэлектронных спиновых функций α(σ) и β(σ), которые являются собственными для одноэлектронного оператора проекции спинового момента на ось квантования [см. (3. 19)].
Функция Θ может быть построена из одноэлектронных спиновых функций следующим образом:
- из пары функций α(σ) и β(σ) составляется двухэлектронная функция
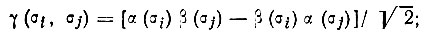 (3.32)
(3.32) - перемножением N/2 функций γ, зависящих от спиновых переменных различных электронов, получается функция
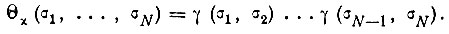 (3.33)
(3.33)
Необходимость индексации функции Θ обусловлена неоднозначностью ее построения из функций γ.
Если конфигурация N-электронной системы содержит п неспаренных АО, то, как это было показано Гайтлером и Румером [51-52], можно построить 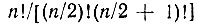 линейно-независимых Θχ. Например, для π-электронной системы бензола, включающей шесть электронов и столько же атомных π-орбиталей, можно построить пять независимых Θχ (χ = 1,...,5).
линейно-независимых Θχ. Например, для π-электронной системы бензола, включающей шесть электронов и столько же атомных π-орбиталей, можно построить пять независимых Θχ (χ = 1,...,5).
Таким образом, оказывается необходимым рассмотрение функции вида
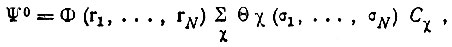 (3.34)
(3.34)содержащей числовые коэффициенты Сχ, которые должны определяться минимизацией полной электронной энергии молекулы.
Согласно принципу Паули, функция состояния многоэлектронной системы должна быть антисимметричной относительно всевозможных перестановок (riσi) → (rj, σj). Функция Ψ0, однако, такой не является, и поэтому ее следует антисимметризовать. Учитывая, что Ф является произведением орбиталей φ, легко видеть, что процедура антисимметризации сохраняет соответствие между парой орбиталей {φi, φj} и некоторой двух-электронной спиновой функцией у для каждого слагаемого в сумме (3.34), характеризующегося некоторым индексом χ и называемого структурой ВС. Можно сказать поэтому, что орбитали φi и φj в некоторой структуре ае спарены. Таким образом, одно из центральных понятий ранних квантовохимических работ - понятие спаривания электронов (точнее, атомных орбиталей) - сохраняется и в более общей теории при правильном учете принципа антисимметрии.
Если каждой орбитали φi сопоставить точку на плоскости, то спаривание двух орбиталей можно представить графически отрезком, соединяющим две соответствующие точки. Так, например, одна из структур молекулы аммиака NH3 может быть представлена диаграммой I (рис. 14). Здесь прерывистой линией обведена группа точек, соответствующих орбиталям атома азота. Стягивая каждую из таких групп в одну точку, можно получить диаграмму II связей атомов в структуре ВС. Аналогично для молекулы азота N2 получаем диаграмму III.
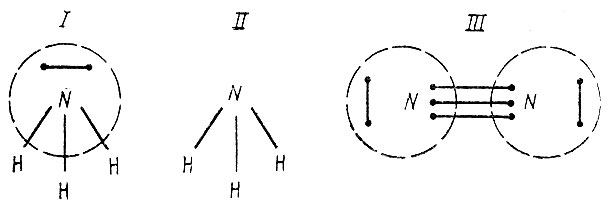
Рис. 14. Диаграммы связей атомов в молекулах NH3 и N2
Иногда возможно с достаточной степенью точности представить электронное строение молекулы одной структурой (приближение идеального спаривания). Тогда кратность связи атомов отождествляется с числом штрихов, соединяющих соответствующие этим атомам группы точек на диаграмме связей, а сами диаграммы вида II становятся идентичными химическим структурным формулам.
В других случаях необходимо учитывать несколько структур . Например, для молекулы бензола следует принимать во внимание по крайней мере две структуры Кекуле. В таких "неклассических" случаях значения кратностей связей должны, очевидно, усредняться по структурам с учетом веса (ωχ) каждой структуры χ в разложении полной многоэлектронной функции Ψ:
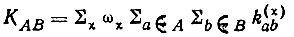 (3.35)
(3.35)
где 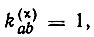 если атомные орбитали аиЬ спарены в структуре χ; 0 - в противном случае;
если атомные орбитали аиЬ спарены в структуре χ; 0 - в противном случае;
А и В обозначают атомы и с оответствующие им наборы атомных орбиталей.
Вес структур зависит, вообще говоря, как от коэффициентов Сχ , так и от перекрывания соответствующих многоэлектронных функций. Вследствие неортогональности последних понятие веса не является ни простым, ни однозначным. Удовлетворительное определение этого понятия, к сожалению, до сих пор отсутствует. Однако в ряде случаев вес структур определяется исключительно из соображений симметрии. Для π-электронной системы бензола, например, вес двух кекулевских структур (рис. 15) одинаков, так как эти структуры эквивалентны по симметрии. Поэтому если пренебречь прочими структурами, то ωχ = 0,5 (χ = 1,2), и с учетом σ-системы, описываемой в приближении идеального спаривания единственной структурой, кратность связи двух соседних атомов углерода равна
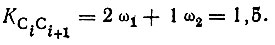 (3.36)
(3.36)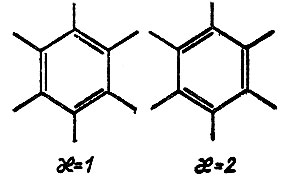
Рис. 15. Кекулевские структуры молекулы бензола
Аналогично для соседних атомов углерода и водорода
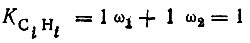 (3.37)
(3.37)(см. рис. 15).
Проблему более серьезную, чем определение веса отдельной структуры, представляет неоднозначность выбора самих структур. Так, для π-электронной системы бензола линейно-независимый базис может включать пять структур, характеризуемых диаграммами I-V (рис. 16)*.
* (Этим диаграммам соответствуют стандартные таблицы Юнга:)
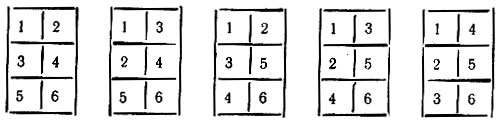
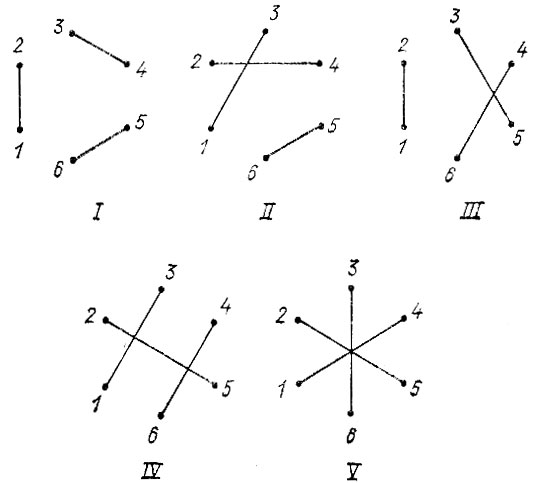
Рис. 16. Линейно-независимые структуры молекулы бензола, отвечающие стандартным таблицам Юнга
Очевидно, что каким бы ни был вес этих структур, π-электронные составляющие кратностей связей С2С3, С4С5 и C1C6 равны нулю, и, следовательно, эти связи, в отличие от связей С1C2, С3С4 и C5С6, оказываются одинарными. Значения кратностей для остальных связей также не согласуются с симметрией молекулы бензола. Набор структур Кекуле и Дьюара для бензола позволяет получить разумные значения кратностей связей. Однако в общем случае сформулированная проблема пока не решена.
Валентность атома А можно определить как сумму кратностей связей, образуемых атомом А:
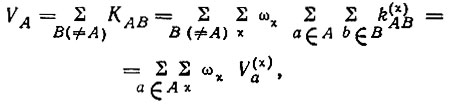 (3.38)
(3.38)
где 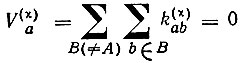 или 1 - вклад атомной орбитали
или 1 - вклад атомной орбитали 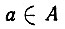 в валентность атома А.
в валентность атома А.
В рамках метода ВС с использованием единственной для каждого атома А валентной конфигурации ГА (без учета ионных структур) для синглетных состояний V(χ)a в действительности не зависит от χ. Учитывая это обстоятельство, а также то, что вес всех структур в сумме равен единице, валентность атома можно представить в виде суммы
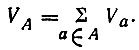 (3.39)
(3.39)В соответствии с последним равенством валентность атома А оказывается равной числу неспаренных орбиталей в валентной конфигурации ГА этого атома, т. е. его спин-валентности, и не зависит, следовательно, ни от выбора линейно-независимого набора структур, ни от используемого способа определения веса отдельной структуры.
Возвращаясь к рассмотренной ранее формальной "химико-алгебраической аналогии", можно сказать, что ее физический смысл был вскрыт в методе валентных связей. Оказалось, что двухкомпонентному вектору 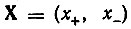 соответствует пара одноэлектронных спиновых функций α(σ) и β(σ), одночленному инварианту
соответствует пара одноэлектронных спиновых функций α(σ) и β(σ), одночленному инварианту  соответствует двухэлектронная спиновая функция
соответствует двухэлектронная спиновая функция 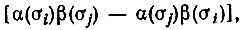 которая на заре квантовой химии называлась спин-инвариантом. Кроме того, произведению одночленных инвариантов в соответствующих степенях отвечает понятие структуры в методе ВС, а валентности как показателю степени VX , в которой X входит в F(X, Y,...), - число неспаренных орбиталей в валентной конфигурации ГX.
которая на заре квантовой химии называлась спин-инвариантом. Кроме того, произведению одночленных инвариантов в соответствующих степенях отвечает понятие структуры в методе ВС, а валентности как показателю степени VX , в которой X входит в F(X, Y,...), - число неспаренных орбиталей в валентной конфигурации ГX.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'