
Развитие метода ВС в работах Полинга. Концепция гибридизации
До сих пор мы рассматривали преимущественно квантово-химические исследования представителей геттингенской школы теоретической физики, выполненные в 1929-1932 гг. В то же самое время в США Полингом и Слэтером был развит альтернативный подход к проблеме электронной структуры молекул, в основе которого были положены две фундаментальные концепции - гибридизации атомных орбиталей и резонанса структура нашедшие впоследствии широкое распространение среди химиков. Остановимся сначала на первой из указанных концепций. Она была сформулирована независимо Хундом, Слэтером, Малликеном* и Полингом, причем последний представил ее в наиболее четком и удобном для химиков виде.
* (Малликеном был введен и сам термин "гибридизация", тогда как Полинг использовал первоначально другое название: "изменение квантования" (change in quantization).)
В Копенгагене, в Архиве Н. Бора, хранится тетрадь с черновыми записями Полинга, относящимися к 1927-1929 гг., т. е. ко времени его стажировки в Европе. На обложке тетради надпись: "Статья Лондона. Общие идеи о связях",*- и далее приписка, относящаяся, по-видимому, к более позднему времени: "Здесь мы имеем первое обсуждение гибридизации".
* (Имеется в виду статья Лондона "Квантовая теория гомеополярной валентности" [60].)
Анализ этого документа показывает, что толчком к созданию Полингом концепции гибридизации послужило изучение им теории эффекта Штарка на атоме водорода, разработанной Шредингером в 1926 г. Эффектом Штарка называют изменение энергетических уровней атомов, молекул и твердых тел под действием электрического поля, обнаруживаемое по сдвигу и расщеплению спектральных линий. Это явление, открытое в 1913 г., было затем интерпретировано Шредингером на основе теории возмущений. При этом вследствие специфического для атома водорода вырождения энергетических уровней по квантовому числу l в отсутствие внешнего электрического поля (что соответствует нулевому приближению теории возмущений) из вырожденных функций должны быть образованы определенные линейные комбинации, называемые правильными функциями нулевого приближения:
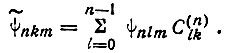 (3.40)
(3.40)"Коэффициенты этих линейных комбинаций определяются из секулярного уравнения, включающего матричные элементы вида
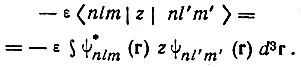 (3.41)
(3.41)В силу нечетности оператора возмущения отличными от нуля будут лишь недиагональные матричные элементы с совпадающими значениями квантовых чисел m и m'. В частности, для n = 2, соответственно двукратному вырождению по l = 0 и 1, получается секулярное уравнение второго порядка
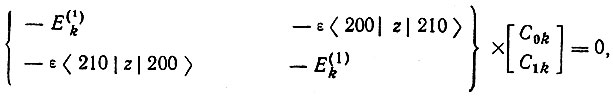 (3.42)
(3.42)
где 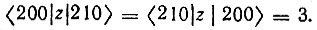
Правильные функции нулевого приближения
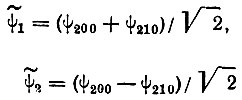 (3.43)
(3.43)являются в этом случае эквивалентными гибридными атомными орбиталями (sp0 - гибридизация) атома водорода в однородном электрическом поле. Обе функции, ψ1 и ψ2, соответствуют нулевой проекции орбитального момента импульса на направление внешнего поля, т. е. являются орбиталями σ-типа. Дважды вырожденные орбитали π-типа ψ21,+1 и ψ21,-1 в аксиальном электрическом поле остаются негибридизованными, и их энергетические уровни не изменяются.
Все сказанное выше справедливо для возбужденных состояний атома водорода с присущим ему специфическим вырождением. Для прочих атомов энергетические уровни зависят как от n, так и от l. Однако и в этом случае также можно было ожидать эффективное смешение атомных орбиталей одного слоя (т. е, орбиталей с одинаковыми n, но разными l), если расстояние между уровнями Еnl и Еnl' достаточно мало по сравнению с энергией возмущения. Такая ситуация, по мнению Полинга, должна реализоваться в молекулах, где атомы находятся в сильном электрическом поле, создаваемом ядрами и электронами других атомов молекулы. Анизотропия этого поля приводит к тому, что орбитальный момент импульса электрона не сохраняется и квантовое число l теряет смысл, поэтому возможно смешение атомных орбиталей как с одинаковыми, так и с различными значениями l. В то же время возможность гибридизации функций разных слоев представляла ь Полингу сомнительной ввиду большой разности в соответствующих энергиях. Исключение могут представлять атомы перех дных элементов, в которых энергии (n - 1) d-AO сопоставимы энергиями ns- и nр-АО.
Следует отметить, однако, что более глубокий анализ проблемы обнаруживает существенное несоответствие между традиционным - назовем его условно "химическим" - представлением о гибридизации, ве ущим свое начало от работ Полинга 1928 и 1931 гг. [71-72], и тем - назовем его условно "физическим" - представлением, к которому приводят изложенные выше рассуждения, натолкнувшие Полинга на идею гибридизации. Так, для молекулы метана, согласно химическим представлениям, атомные орбитали углерода должны быть гибридизованы в четыре (гибридных) АО hi, ориентированных к атомам водорода и обеспечивающих представление локализованных на связях C-Hi двухцентровых МО в виде
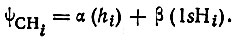 (3.44)
(3.44)Преобразования тетраэдрической группы симметрии переводят гибридные АО hi друг в друга. Эти орбитали были названы поэтому Леннард-Джонсом (1949 г.) "эквивалентными" относительно точечной группы симметрии молекулы (Td). В тоже время правильные функции нулевого приближения должны классифицироваться по неприводимым представлениям (НП) этой группы. Такими трансформационными свойствами обладают негибридные 2s-, 2р-орбитали атома углерода. При этом 2s-АО преобразуются по полносимметричному,а трехкратно вырожденные 2р-АО-по трехмерному НП группы Td. Таким образом, анализ концепции гибридизации, основанный на эффекте Штарка, приводит к весьма своеобразной ее формулировке, при которой атомные орбитали углерода в молекуле СH4 оказываются негибридизованными в традиционном смысле этого слова. Можно сказать, что при таком подходе мы получаем скорее концепцию антигибридизации, чем гибридизации.
Разумеется, ни в 1928 г., ни даже в 1931 г. проведенный выше анализ был еще невозможен, так как пространственная симметрия молекулы учитывалась в то время только качественно, без привлечения математического аппарата теории групп. С исторической точки зрения необходимость введения концепции гибридизации была обусловлена потребностью объяснить в терминах метода ВС такие явления, как локализованный характер химических связей во многих соединениях, их направленность o в пространстве, аддитивность и трансферабельность ассоциируемых с отдельными связями молекулярных свойств, а также геометрию молекул. При этом геометрическим аспектам придавалось особое значение. По мнению Полинга и многих других химиков, именно гибридизация атомных орбиталей является фактором, определяющим симметрию молекулы, а отчасти и ее геометрические параметры. К сожалению, при этом произошло обращение причинно-следственных связей между гибридизацией и симметрией. Часто утверждают, что первая является причиной последней. Так, например, в молекуле метана промотирование электрона из 2s- в 2р-состояние с образованием 2s2р3-конфигурации углерода позволяет образовать четыре эквивалентные АО, эффективно перекрывающиеся с 1s-AO атомов водорода. Очевидно, что при этих рассуждениях исходным пунктом является известная (тетраэдрическая) симметрия молекулы метана, из которой делается вывод о характере гибридизации в этой же молекуле. Но когда от этой молекулы переходят к другим насыщенным соединениям углерода и утверждают, что вследствие тетраэдрической гибридизации орбиталей атома углерода его соседи должны находиться в углах тетраэдра, то создается иллюзия, что причиной такой геометрической структуры этих соединений является тетраэдрическая гибридизация. В действительности же в основе этих рассуждений лежит несвязанное с концепцией гибридизации предположение о сходстве геометрической структуры рассматриваемых соединений. Более того, выполненные недавно детальные расчеты электронной структуры молекулы метана [89] для основной и искаженной геометрических конфигураций показали, что для тетраэдрической конфигурации полная электронная энергия этой молекулы отнюдь не o минимальна. Тетраэдрической конфигурации метана соответствует максимум полной электронной энергии (рис. 17)!
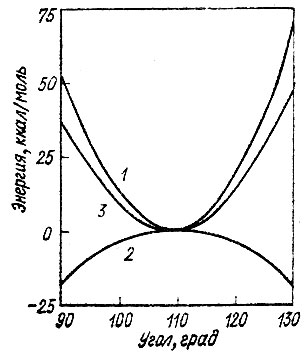
Рис. 17. Зависимость ядерной (1), электронной (2) и полной энергии (3) молекулы метана от валентного угла (Td →C3U)
Возникает вопрос: почему же тогда для молекулы СН4 реализуется тетраэдрическая геометрия? Как видно из рис. 17 причиной образования такой высокосимметричной структуры является то, что для нее минимальной оказывается энергия Межъядерного отталкивания четырех атомов водорода*. Таким образом, гибридизация АО не только не объясняет особенностей геометрического строения соединений углерода (и, очевидно, не только углерода), но в известной мере противоречит экспериментальным фактам. Конечно, противоречие снимается, если не пытаться объяснять геометрическое строение химических соединений гибридизацией образующих их атомов, а рассматривать определенный тип гибридизации как следствие определенной геометрии соединения.
* (Следует отметить, что возможность такого объяснения геометрии молекул отмечали в 1930 г. Гайтлер и Румер [51].)
Но не является ли тогда концепция гибридизации излишней? Было бы весьма печально, если б одно из фундаментальных понятий теории химической связи оказалось ненужным или даже ложным. Однако, как мы уже отмечали, объяснение геометрии молекул является лишь одной из задач, для решения которой привлекалась указанная концепция. Не менее важной являлась задача объяснения аддитивности и трансферабельности молекулярных свойств, обусловленных локализацией химических связей. Эта проблема в настоящее время успешно решается в рамках метода молекулярных орбиталей (см. гл. 4). Но уже в рамках метода ВС введенные Полингом представления о гибридизации позволили ему объяснить эквивалентность связей С-Н в метане, которая до этого казалась парадоксальной.
"Я тогда интересовался,- вспоминал впоследствии Полинг,- химическими связями, пытался понять, что они собой представляют. Это была головоломная проблема... Физики уверяли, что атом углерода имеет на внешней оболочке разные электроны - два s-электрона и два p-электрона - с разными, естественно, орбиталями. Но химики говорили, что этого не может быть, так как углерод образует четыре одинаковые связи... Как можно было примирить эти суждения? Я много размышлял над этой проблемой, и мне пришла в голову мысль, что s- и р-орбитали могут как-то сочетаться друг с другом, перемешиваться так, что образуются четыре одинаковые связи. Но подтвердить свою догадку точным математическим расчетом я не мог, задача была слишком сложна. Прошел почти год. И вдруг меня осенило, что смешанные, или гибридные, орбитали углерода можно рассчитать с помощью простых алгебраических действий. Для этого важно учесть зависимость электронных s- и р-орбиталей от направления в пространстве и сложить их так, чтобы гибридные орбитали приняли максимально вытянутую форму. В тех местах, где гибридные орбитали наиболее вытянуты, как раз и образуются химические связи между атомами" [19, с. 94-95]. При этом Полинг независимо от других исследователей ввел понятие о валентном состоянии атома в молекуле, отличном от его основного свободного состояния. Остановимся теперь более подробно на работе Полинга 1931 г. [72]. Обобщая метод Гайтлера-Лондона на многоатомные молекулы, он сформулировал шесть постулатов, отражающих основные свойства двухэлектронных связей.
- Двухэлектронная связь образуется при взаимодействии неспаренных атомных электронов.
- Образование связи сопровождается спариванием спиновых моментов отдельных электронов.
- Спаренные электроны некоторой связи не могут одновременно принадлежать другим связям.
- Для двухэлектронной связи определяющими являются те резонансные интегралы, которые включают лишь по одной атомной орбитали от каждого атома.
- Из двух атомных орбиталей с одинаковой зависимостью более прочную связь образует та, амплитуда которой в направлении связи больше. Для заданной атомной орбитали связь образуется в направлении ее ориентации.
- Из двух атомных орбиталей с общей угловой зависимостью более прочную связь обеспечивает орбиталь с меньшим средним радиусом (соответствующая более низкому энергетическому уровню).
Далее Полинг рассматривает случай двух атомов A и B, связанных двухэлектронной связью. Он полагает для простоты, что все прочие электроны в системе спарены и представляют собой или неподеленные пары, или пары электронов, связывающие атомы A и В с другими атомами. При этом Полинг предлагает использовать в качестве атомных орбиталей не только сферические функции, характеризуемые квантовыми числами l и m, но и их линейные комбинации, т. е. гибридные атомные орбитали. "Допустим,- пишет Полинг,- что атом А представляет для образования связи несколько одноэлектронных собственных функций приблизительно одинаковой энергии и что изменение в энергии проникновения в остов (атома) (in energy of penetration info the core) пренебрежимо мало по сравнению с энергией связи. Тогда мы можем принять для одноэлектронных собственных функций следующее выражение*:
* (Мы несколько видоизменили обозначения в приведенной формуле (3.45); n, l, m - квантовые числа; i-номер гибридной АО.)
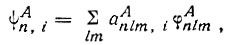 (3.45)
(3.45)
в котором 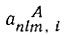 - численные коэффициенты, a
- численные коэффициенты, a 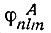 - определенный набор одноэлектронных собственных функций типа тех, которые получаются при разделении переменных в волновом уравнении в полярных координатах. Из функций ψn,lA, можно образовать такую группу функций, которая будет относиться к атому Лик связанным с ним атомам, кроме атома B, так что все электроны оказываются спаренными, кроме одного... Из орбиталей атома В можно образовать аналогичную группу с одним неспаренным электроном.
- определенный набор одноэлектронных собственных функций типа тех, которые получаются при разделении переменных в волновом уравнении в полярных координатах. Из функций ψn,lA, можно образовать такую группу функций, которая будет относиться к атому Лик связанным с ним атомам, кроме атома B, так что все электроны оказываются спаренными, кроме одного... Из орбиталей атома В можно образовать аналогичную группу с одним неспаренным электроном.
Тогда энергия взаимодействия двух групп может быть рассчитана с помощью вариационного принципа путем замены собственной функции молекулы на собственные функции этих двух групп так, чтобы при этом удовлетворялись требования симметрии" [72, с. 1369].
Иными словами, введенные Полингом гибридные орбитали должны определяться минимизацией полной энергии молекулы относительно коэффициентов 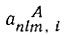 . Однако учитывая, что резонансные интегралы, определяющие в значительной степени полную энергию системы, тем больше, чем сильнее перекрываются соответствующие орбитали, Полинг предложил заменить вариационный критерий выбора гибридных АО более простым критерием их максимального перекрывания.
. Однако учитывая, что резонансные интегралы, определяющие в значительной степени полную энергию системы, тем больше, чем сильнее перекрываются соответствующие орбитали, Полинг предложил заменить вариационный критерий выбора гибридных АО более простым критерием их максимального перекрывания.
В частном случае, когда имеются s- и p-АО с одинаковыми и фиксированными радиальными функциями, перекрывание определяется исключительно угловой зависимостью атомных орбиталей. Эта угловая зависимость такова, что "р-электроны будут образовывать более прочные связи, чем s-электроны, причем связи, образованные р-электронами атома, ориентируются под прямыми углами относительно друг друга" [72, с. 1371]. Однако эти АО (s- и р-типа) могут быть преобразованы в гибридные орбитали, которые обеспечивают образование более прочных связей в определенных направлениях.
Таким образом, концепция гибридизации Полинга сводилась к предположению, что каждая гибридная атомная орбиталь ориентирована по определенной связи, т. е. ее угловая зависимость характеризуется максимальной амплитудой в направлении атома, связь с которым она обеспечивает. Следуя работе Гайтлера и Лондона, Полинг полагает, что взаимодействие между химически связанными атомами можно рассматривать как возмущение. Для учета последнего в случае вырождения энергетических уровней необходимо построение правильных функций нулевого приближения. Одна из этих функций соответствует наименьшей (отрицательной) энергии возмущения. Полинг предложил в качестве такой функции выбрать гибридную орбиталь,- ориентированную в направлении связи. В соответствии с теорией возмущений можно ожидать, что гибридизация будет тем более существенной, чем меньше разность энергий s- и р-АО по сравнению с энергией возмущения, обусловленной химическим взаимодействием. Вид гибридных орбиталей в некоторых случаях можно было определить из условий их ортонормированности и эквивалентности. Если бы 2s- и 2р-АО имели одинаковую радиальную зависимость
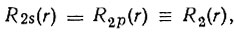
то гибридные АО имели бы вид
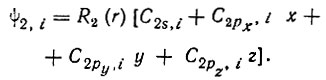 (3.46)
(3.46)Именно такое представление гибридных АО и было дано Полингом (только в иных обозначениях). В действительности же радиальные атомные функции для разных значений квантового числа l различаются. Однако это обстоятельство не могло быть учтено в 30-х годах, хотя бы потому, что аналитические АО многоэлектронных атомов еще не были вычислены. Форму гибридной орбитали, точнее ее угловую зависимость, можно характеризовать полярной диаграммой:
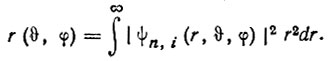 (3.47)
(3.47)Эта диаграмма может быть построена независимо от того, совпадают или нет радиальные функции, входящие в атомные орбитали. На рис. 18 приведены примеры этих диаграмм.
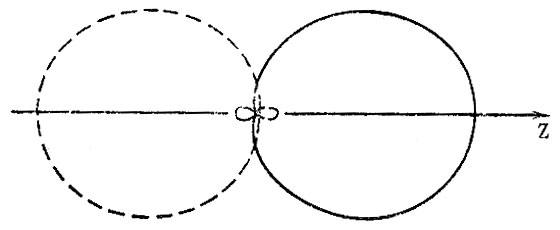
Рис. 18. Полярные диаграммы для spsub0/sub-гибридных АО углерода (одна из двух эквивалентных гибридных АО изображена сплошной линией, вторая - штриховой)
Теория гибридизации интенсивно обсуждается в современной литературе [22, 63, 73, 74, 88, 89], поэтому интерес к ней выходит за чисто исторические рамки. В связи с этим остановимся здесь на некоторых вопросах, связанных с попытками расширить первоначальную концепцию Полинга.
Вид гибридных орбиталей (т. е. коэффициенты гибридизации) при достаточно высокой симметрии окружения рассматриваемого атома может определяться из условий ортонормированности и эквивалентности гибридных орбиталей, как и в данном примере молекулы метана. В общем же случае необходимо привлечение дополнительных принципов, количественно определяющих коэффициенты гибридизации, таких, как, например, принцип максимального перекрывания. Согласно этому принципу, химическую связь образует пара сильно перекрывающихся гибридных атомных орбиталей, относящихся к соседним "непосредственно связанным" атомам в молекуле. Неподеленные электронные пары или вакантные орбитали описываются гибридными орбиталями либо неперекрывающимися, либо слабо перекрывающимися со всеми остальными АО как рассматриваемого, так и всех прочих атомов молекулы. Кроме того, по интегралам перекрывания для двух гибридных АО, обеспечивающих химическую связь атомов, можно судить о прочности этой связи, причем предполагается, что при отсутствии перекрывания атомных орбиталей образование химической связи невозможно.
При использовании принципа максимального перекрывания в его обобщенной формулировке, данной Малликеном в 1950 г., следует преобразовать орбитали каждого атома так, чтобы они, оставаясь ортогональными друг к другу, максимально (или минимально) перекрывались с АО других атомов, образующих молекулу*. Используя аналитические шестиэкспоненциальные функции Клементи, мы провели для примера расчеты гибридных орбиталей в молекулах NН3, Н2O и др. Для гидридов АНn (n < 4) орбитали атома А могут быть унитарно преобразованы таким образом, что выделяются отдельные гибридные АО, строго ортогональные ко всем остальным орбиталям атомов молекулы. Например, для молекулы аммиака полносимметричная гибридная АО азота
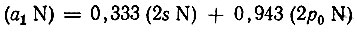 (3.48)
(3.48)ортогональна не только к другим орбиталям атома азота, но и к 1s-АО водорода. Аналогично для молекулы воды гибридная орбиталь кислорода
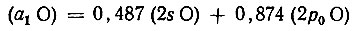 (3.49)
(3.49)и 2py-АО также ортогональны ко всем прочим АО в молекуле. Очевидно, что приведенные гибридные орбитали согласно принципу максимального перекрывания должны описывать неподеленные электронные пары атомов N и О.
* (При этом Малликен учитывал (в отличие от Полинга) не только угловые, но и радиальные функции АО.)
Эти результаты свидетельствуют о том, что принцип максимального перекрывания приводит к явно завышенному вкладу s-орбиталей в гибридные АО неподеленных пар. Соответственно завышенным оказывается вклад s-AO в образование химической связи*.
* (То, что неподеленные пары должны иметь преимущественно s-характер, следует как из химических соображений, основанных на сопоставлении орбитальных энергий 2s и 2р-АО (E2s = 25,6 эВ, E2р = 13,2 эВ для атома азота и E2s = 33,7 эВ, E2р = 15,9 эВ для атома кислорода), так и из квантовохимических расчетов последних лет, выполненных в формализме матрицы плотности.)
Теперь вернемся к работам Полинга. Следует отметить, что сам он не следовал строго принципу максимального перекрывания. Фактически Полинг использовал другой критерий, а именно требование ориентации гибридных АО по линии связи, и оперировал при этом исключительно с угловыми функциями, полагая, что радиальные компоненты 2s- и 2р-АО тождественны. Существенным (и, можно сказать, парадоксальным) было то, что такой подход, называемый часто "теорией направленных валентностей" (термин Полинга), давал результаты более разумные, чем те, которые можно было получить, строго следуя принципу максимального перекрывания. Поэтому вряд ли можно утверждать, что последний, учитывающий наряду с угловой также и радиальную зависимость АО, явился развитием теории направленных валентностей.
Не очень ясен вопрос и о другом ограничении ранней концепции гибридизации, суть которого состоит в том, что под преобразованием АО понимались не все унитарные преобразования, затрагивающие орбитали как с одинаковыми, так и с различными квантовыми числами момента импульса, а лишь ортогональные (т. е. вещественные) преобразования вещественных АО, в результате чего получались вещественные гибридные функции. Последние же не могут образовывать между направлениями своей ориентации угол меньше 90°.Это ограничение особенно сильно сказалось в органической квантовой химии, так как вынуждало химиков использовать старую идею Байера о напряженных химических связях, что приводило к многочисленным искусственным построениям, подробно рассмотренным в монографии Г. В. Быкова [5]. В 1967-1969 гг. Мартенссоном была выдвинута теория комплексной гибридизации [68], по которой углы между гибридными АО могут быть и меньше 90°.
Однако получаемые при этом волновые функции системы являются комплексными и не могут быть преобразованы в вещественные, хотя гамильтониан задачи не содержит членов, отвечающих магнитным взаимодействиям. Таким образом, вопрос о том, что же является развитием концепции Полинга - теория Мартенссона или модифицированная идея Байера, остается открытым.
В заключение этого параграфа остановимся на месте понятия гибридизации в логической структуре метода ВС. Использование гибридных орбиталей является необходимым условием представления многоэлектронной функции молекулы одной структурой (приближение идеального спаривания). Иными словами, концепция гибридизации позволяет наиболее просто интерпретировать классические структурные формулы в терминах метода ВС и в этом смысле она альтернативна концепции резонанса.
Кроме того, гибридные орбитали образуют оптимальный базис для представления локализованных молекулярных орбиталей. Таким образом, концепция гибридизации оказывается полезной при согласовании квантовомеханического описания молекул с их описанием в рамках классической теории строения.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'