
Канонические и локализованные молекулярные орбитали
Молекулярные орбитали fiопределяются обычно как собственные функции некоторого одноэлектронного гамильтониана 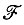 :
:
 (4.23)
(4.23)
В качестве 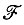 должен использоваться в принципе оператор Хартри-Фока (фокиан), оптимальным образом учитывающий согласованное взаимодействие электронов в молекуле (см. гл. 3). Этот оператор часто аппроксимируется полуэмпирическими модельными одноэлектронными гамильтонианами. В любом случае предполагается, что симметрия гамильтониана
должен использоваться в принципе оператор Хартри-Фока (фокиан), оптимальным образом учитывающий согласованное взаимодействие электронов в молекуле (см. гл. 3). Этот оператор часто аппроксимируется полуэмпирическими модельными одноэлектронными гамильтонианами. В любом случае предполагается, что симметрия гамильтониана 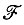 соответствует симметрии молекулы. При этом собственные функции гамильтониана, инвариантного относительно преобразований некоторой точечной группы симметрии, должны преобразовываться по неприводимым представлениям этой группы. Молекулярные орбитали, обладающие такими свойствами симметрии и определяемые как собственные функции одноэлектронного гамильтониана, называются каноническими молекулярными орбиталями. Уже из свойств симметрии канонических МО ясно, что их нельзя сопоставить отдельным химическим связям в молекуле. Канонические МО существенно делокализованы и не отражают экспериментально подтверждаемые аддитивность и транс-ферабельность (т. е. переносимость из одной, в другую родственную молекулу) многих молекулярных свойств.
соответствует симметрии молекулы. При этом собственные функции гамильтониана, инвариантного относительно преобразований некоторой точечной группы симметрии, должны преобразовываться по неприводимым представлениям этой группы. Молекулярные орбитали, обладающие такими свойствами симметрии и определяемые как собственные функции одноэлектронного гамильтониана, называются каноническими молекулярными орбиталями. Уже из свойств симметрии канонических МО ясно, что их нельзя сопоставить отдельным химическим связям в молекуле. Канонические МО существенно делокализованы и не отражают экспериментально подтверждаемые аддитивность и транс-ферабельность (т. е. переносимость из одной, в другую родственную молекулу) многих молекулярных свойств.
В то же время каждой канонической МО соответствует одно-электронная энергия εi, которая, согласно теореме Купманса, определяет потенциал ионизации молекулы, то есть энергию удаления электрона из i-гo одноэлектронного состояния в молекуле. Эти орбитали могут успешно использоваться и при оценках энергий электронных возбуждений.
В однодетерминантном приближении канонические МО являются одновременно естественными молекулярными орбиталямц в том смысле, что одноэлектронная плотность представима в виде естественного разложения:
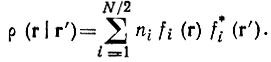 (4.24)
(4.24)Весьма существенным обстоятельством является (N/2)-кратное вырождение естественных заселенностей n1 = ...nN/2 = 2. Это вырождение обусловлено однодетерминантным приближением и может быть названо случайным в отличие от вырождения, наблюдаемого при достаточно высокой симметрии молекулы. Иными словами, в одноэлектронном (точнее однодетерминантном) приближении все МО, определяемые уравнением (4.23), классифицируются на "занятые" МО, заселенные парами электронов, и "свободные" или виртуальные МО, не включаемые в детерминант Слэтера и характеризуемые нулевыми электронными заселенностями.
Очевидно, что в силу указанного вырождения естественное разложение и распределение электронной плотности не изменяются при унитарном преобразовании орбиталей fi. В частности, унитарным преобразованием канонических МО можно попытаться построить МО, локализованные на отдельных атомах и связях. Такие локализованные молекулярные орбитали могут преобразовываться по приводимым представлениям точечной группы симметрии молекулы и в этом отношении существенно отличаются от канонических МО. Если некоторое преобразование симметрии меняет местами эквивалентные атомы или связи, то локализованные на этих атомах и связях МО также должны поменяться местами.
В качестве примера рассмотрим молекулу метана СН4. Канонические МО, представленные линейными комбинациями валентных АО для молекулы метана, могут иметь вид:
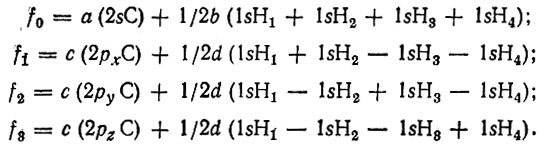
Орбиталь f0 является полносимметричной (неприводимое представление a1 тетраэдр и ческой группы симметрии Td). Орбитали f1, f2, f3 преобразуются по трехмерному неприводимому представлению t2 и соответствуют одному и тому же трехкратно вырожденному одноэлектронному уровню εt2, определяющему первый потенциал ионизации молекулы метана.
Указанные канонические МО можно преобразовать в четыре эквивалентные относительно преобразований группы Тd, локализованные МО:

где i = 1, 2, 3, 4 и hiC - гибридные АО атома углерода, определяемые равенствами:

Как гибридные АО hiC, так и локализованные 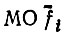 преобразуются по приводимому четырехмерному представлению группы Тd: при операциях симметрии, образующих эту группу,
преобразуются по приводимому четырехмерному представлению группы Тd: при операциях симметрии, образующих эту группу,  либо не изменяется, либо переводится в другую локализованную МО. Именно в этом смысле гибридные АО hiC и локализованные
либо не изменяется, либо переводится в другую локализованную МО. Именно в этом смысле гибридные АО hiC и локализованные  называются эквивалентными. Легко видеть, что
называются эквивалентными. Легко видеть, что 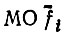 могут быть отнесены к отдельным связям С-Hi, и их локализация на отдельных связях будет тем более строгой, чем меньше разность |b-d|. Локализацию можно считать абсолютной, если а = с и b = d, но в действительности эти равенства не выполняются строго.
могут быть отнесены к отдельным связям С-Hi, и их локализация на отдельных связях будет тем более строгой, чем меньше разность |b-d|. Локализацию можно считать абсолютной, если а = с и b = d, но в действительности эти равенства не выполняются строго.
Каждой из эквивалентных локализованных МО соответствует одно общее значение одноэлектронной энергии:
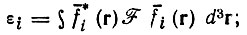 (4.25)
(4.25)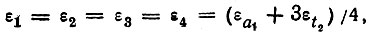 (4.26)
(4.26)которому, однако, нельзя сопоставить потенциал ионизации или иную наблюдаемую характеристику молекулы.
Следует отметить также тесную связь понятий локализации МО и гибридизации АО, которую иллюстрирует рассмотренный выше пример. Гибридизация АО должна обеспечивать представление локализованных молекулярных орбиталей минимальным числом базисных гибридных атомных орбиталей. В свою очередь каждая гибридная АО должна участвовать в минимальном числе локализованных МО.
Как правило, построение локализованных МО из одних лишь соображений симметрии не является возможным и необходимо привлечение дополнительных критериев и определенной методики локализации. К настоящему времени разработано несколько методов преобразования канонических МО, найденных тем или иным путем, в МО, локализованные на отдельных атомах и связях. Некоторые из этих методов мы рассмотрим ниже.
Методы Эдмистона-Рюденберга и Бойса. В методе, предложенном Эдмистоном и Рюденбергом [38], определяются ор-битали самосогласованного поля, которые отделены друг от друга насколько это возможно, хотя на них заранее не накладывается условие определенной локализации в пространстве или на отдельных атомах и связях.
Среднее межорбитальное разделение характеризуется суммой кулоновских двухэлектронных интегралов:
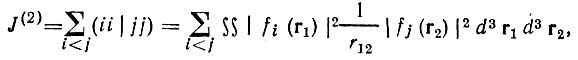 (4.27)
(4.27)причем унитарное преобразование локализации
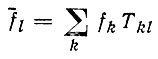 (4.28)
(4.28)должно обеспечивать минимальность величины J(2). В силу равенства
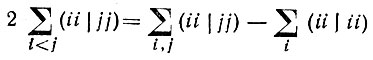 (4.29)
(4.29)и инвариантности первой суммы в правой части этого равенства относительно преобразования (4.28) минимум величины J(2) соответствует максимуму
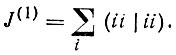 (4.30)
(4.30)J(1) характеризует в среднем плотность орбиталей fi в смысле интеграла
 (4.31)
(4.31)определяющего энергию отталкивания двух электронов, находящихся в одном и том же i-м одноэлектронном состоянии, заданном орбиталью fi. Из равенства
 (4.32)
(4.32)
и инвариантности 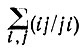 следует далее, что минимум J(2) и максимум J(1) обеспечивают минимальное значение суммы обменных двухэлектронных интегралов:
следует далее, что минимум J(2) и максимум J(1) обеспечивают минимальное значение суммы обменных двухэлектронных интегралов:
 (4.33)
(4.33)На возможность использования энергии обменного взаимодействия К в качестве критерия локализации МО указывали Леннард-Джонс и Попл. Минимизация К позволяет максимально приблизить выражение для энергии электронного взаимодействия к виду, соответствующему аппроксимации многоэлектронной функции простым произведением спин-орбиталей. В этом случае каждому электрону, точнее каждой паре электронов, можно приписать определенную локализованную орбиталь. Такое соответствие между электронами и орбиталями нарушается при антисимметризации N-электронной функции-произведения, т. е при учете неразличимости электронов и связанной с ней антисимметричностью точной многоэлектронной функции относительно перестановок электронов.
Об уменьшении при локализации МО обменной энергии электронного взаимодействия, а также об увеличении J(1) и уменьшении J(2) по сравнению со значениями, соответствующими каноническим МО, можно судить по данным табл. 4, полученным в работе [82] для гидридов бора.

Таблица 4. J(1), J(2) и K для исходных канонических и локализованных МО
В табл. 5 приведены результаты Эдмистона и Рюденберга по локализации МО в молекулах N2, СО и BF. Первая из этих молекул характеризуется симметрией D∞h, гетеронуклеарные СО и BF - симметрией C∞ν. Их канонические МО должны поэтому классифицироваться на σ- и π-орбитали. Каждая из рассматриваемых изоэлектронных молекул содержит десять электронов в σ-системе и четыре - в π-системе. Четыре из десяти σ-электронов принадлежат атомным остовам в том смысле, что описываются МО (iA), локализованными на внутренних (остовных) σ-оболочках. Эти орбитали практически идентичны атомным 1s-орбиталям. Следующие четыре σ-электрона описываются локализованными МО (lА), представляющими неподеленные электронные пары атомов. Оставшиеся два электрона должны относиться, очевидно, к связывающей σ-орбитали. Однако локализация МО по методу Эдмистона и Рюденберга приводит к связывающим МО иной симметрии. Эти локализованные МО (bi) не могут быть отнесены ни к σ-, ни к π-типу. Они образуют систему трех эквивалентных, так называемых банановых МО, переводящихся друг в друга преобразованиями группы С3υ и определяемых с точностью до произвольного поворота относительно молекулярной оси. В ряду молекул N2, CO, BF характер трех эквивалентных связывающих МО bi монотонно меняется от строго ковалентного для N2 до существенно поляризованного в направлении атома фтора для молекулы BF. В последнем случае они подобны неподеленным парам атома фтора.
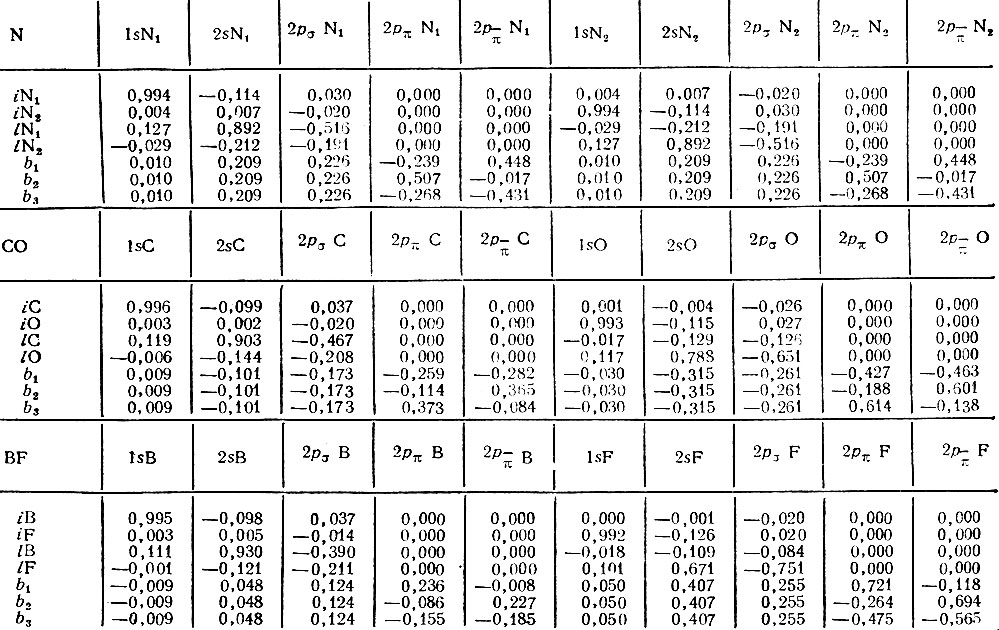
Таблица 5. Орбитали Эдмистона-Рюденберга в молекулах N2, CO и BF
Практическая реализация метода Эдмистона-Рюденберга предполагает использование формализма самосогласованного поля и вычисление большого числа двухэлектронных интегралов, что представляет довольно сложную математическую задачу. Количество таких интегралов, как и время, необходимое для максимизации J(1) (или минимизации J(2) и К), очень быстро растет с увеличением числа электронов в системе и числа базисных АО, используемых для представления МО.
Следует отметить также, что метод Эдмистона и Рюденберга, строго говоря, не гарантирует соответствия между локализованными МО и отдельными атомами или связями. Впрочем, это обстоятельство может рассматриваться не только как недостаток, но и как достоинство метода, поскольку он допускает в принципе представление МО в базисе, существенно отличающемся от многоцентрового базиса АО.
В вычислительном отношении более удобным, чем метод Эдмистона-Рюденберга, является метод Бойса [31]. В качестве критерия, определяющего степень локализации МО, в этом методе используется сумма квадратов расстояний (Ri) между центрами тяжести орбиталей:
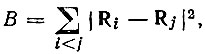 (4.34)
(4.34)где
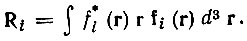 (4.35)
(4.35)Локализованные по Бойсу МО характеризуются максимальным разделением в пространстве по критерию В и одновременно минимальными среднеквадратическими радиусами, точнее минимальным значением суммы их квадратов:
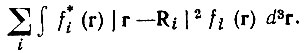 (4.36)
(4.36)Недостатком метода Бойса является то, что он не обеспечивает эффективного разделения валентных и остовных АО. Например, 1s- и 2s-орбитали сферически-симметричны и никаким преобразованием нельзя изменить расстояния между их центрами тяжести (которое всегда равно нулю). С другой стороны, смешение остовной 1s-орбитали с валентными np-орбиталями должно приводить к увеличению расстояния от нулевого до некоторого конечного (для гибридных АО) значения. Максимуму значения В при этом должна соответствовать тетраэдрическая гибридизация 1s- и nр-АО. В действительности наряду с остовной 1s-орбиталью следует принимать во внимание и валентную ns-AO. Именно она должна смешиваться с другими валентными АО. Но с учетом сказанного выше ясно, что метод Бойса может приводить к завышенному вкладу остовных АО в связывающие МО.
Метод проецирования. Метод проецирования, предложенный в работах Полака [73] и позднее развитый Роби [74], основан на том, что одноэлектронная матрица плотности ρ1(x|x') в однодетерминантном приближении является ядром оператора проектирования на подпространство занятых молекулярных спин-орбиталей. Поэтому для любой нормированной спин-орбитали ψ проекционная норма
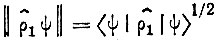 (4.37)
(4.37)удовлетворяет неравенству
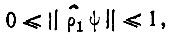 (4.38)
(4.38)
причем 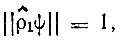 если спин-орбиталь ψ целиком принадлежит подпространству занятых молекулярных спин-орбиталей, и
если спин-орбиталь ψ целиком принадлежит подпространству занятых молекулярных спин-орбиталей, и  если спин-орбиталь ψ ортогональна к этому подпространству.
если спин-орбиталь ψ ортогональна к этому подпространству.
Следуя Полаку, локализованную на атоме А МО, описывающую неподеленную электронную пару или орбиталь внутренней оболочки атома, можно определять как линейную комбинацию орбиталей атома А (т. е. как гибридную АО этого атома):
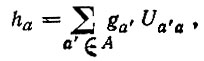 (4.39)
(4.39)
максимизирующую проекционную норму  . Если бесспиновая одноэлектронная матрица плотности ρ(r|r') представлена в базисе АО g матрицей
. Если бесспиновая одноэлектронная матрица плотности ρ(r|r') представлена в базисе АО g матрицей
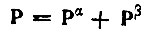 (4.40)
(4.40)и базис g характеризуется матрицей перекрывания S, причем S'a = 0 для а, а' ∈ А, то столбец Ua, представляющий искомую гибридную АО ha, является собственным вектором матрицы Q(A) образуемой матричными элементами (SPS)aa' ∈ А, и этот собственный вектор отвечает максимальному собственному значению nа. Когда последнее равно двум, гибридная АО ha будет в точности совпадать с естественной МО, описывающей неподеленную электронную пару; когда na ≈ 2, гибридная АО ha будет аппроксимировать такую орбиталь.
Двух-, трех- ... и K-центровые МО, локализованные на атомных группах (связях) G = (A1,..., AK) и представленные линейными комбинациями вида
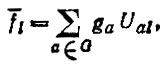 (4.41)
(4.41)определяются в методе проецирования аналогичным образом, т. е. посредством диагонализации матриц Q(G) при условии ортонормированности
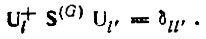 (4.42)
(4.42)Согласно работам [73, 74], процедура локализации МО осуществляется в следующей последовательности:
1) сначала определяются одноцентровые  , локализованные на остовных и валентных оболочках отдельных атомов;
, локализованные на остовных и валентных оболочках отдельных атомов;
2) одноцентровые  исключаются из исходного базиса преобразованием
исключаются из исходного базиса преобразованием
 (4.43)
(4.43)и канонической ортонормировкой линейно-зависимого набора орбиталей g';
3) в полученном ортонормированием базисе, включающем меньшее число орбиталей, чем исходный базис АО g, определяются двухцентровые МО 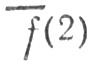 ;
;
4) если число найденных 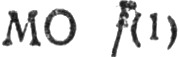 и
и  в сумме отлично от числа всех занятых канонических МО, аналогичным образом определяются многоцентровые
в сумме отлично от числа всех занятых канонических МО, аналогичным образом определяются многоцентровые 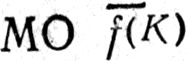 последовательно для К = 3, 4,..., пока число локализованных МО не сравняется с числом занятых канонических МО.
последовательно для К = 3, 4,..., пока число локализованных МО не сравняется с числом занятых канонических МО.

Таблица 6. Одноэлектронная матрица плотности для молекулы метана, представленная в ортогонализованном (по Лёвдину) базису АО
Следует отметить, однако, что такую последовательность построения локализованных МО не всегда можно считать оправданной. Например, нет оснований для поиска локализованных трехцентровых МО диборана в подпространстве занятых МО, более узком, чем рассматриваемое при построении двухцентровых МО этой молекулы.
Существенным недостатком метода проектирования является то, что он приводит к неортогональным наборам локализованных МО. В частности, орбиталь hа, принадлежащая атому А и перекрывающаяся с орбиталью hb, атома В, принадлежит отчасти и последнему атому, а перекрывание МО 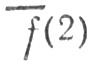 l, локализованной на связи АВ, и МО
l, локализованной на связи АВ, и МО 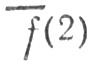 l локализованной на связи АС, означает, что
l локализованной на связи АС, означает, что 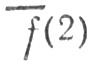 l и
l и 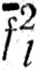 делокализованы на связи АС и АВ соответственно. В работах [73, 74] предлагалось ортогонализовывать наборы
делокализованы на связи АС и АВ соответственно. В работах [73, 74] предлагалось ортогонализовывать наборы 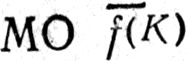 по методу Лёвдина [62]. Однако локализация получаемых таким образом МО не будет оптимальной в смысле максимума проекционной нормы
по методу Лёвдина [62]. Однако локализация получаемых таким образом МО не будет оптимальной в смысле максимума проекционной нормы 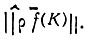 . Поэтому метод проектирования удобно применять в тех случаях, когда требуется выделить лишь одну локализованную МО, например МО, реализующую донорно-акцепторную связь в аддукте Н3В. NH3.
. Поэтому метод проектирования удобно применять в тех случаях, когда требуется выделить лишь одну локализованную МО, например МО, реализующую донорно-акцепторную связь в аддукте Н3В. NH3.
Представляется разумным формулировать метод проектирования в ортогонализованном по Лёвдину многоцентровом базисе АО, орбитали которого могут рассматриваться как "модифицированные АО", представляющие атомы в химическом соединении. К такому базису относятся фактически результаты полуэмпирических расчетов МО в приближении полного пренебрежения дифференциальным перекрыванием. Следует отметить, что ортогонализация многоцентрового базиса АО g обеспечивает ортогональность гибридных АО неподеленных электронных пар, но двухцентровые или многоцентровые локализованные МО, определяемые методом проектирования, остаются при этом неортогональными, если связиi на которых они локализованы, имеют общие атомы.
Рассмотрим теперь в качестве примера, иллюстрирующего метод проектирования, данные по локализации МО и гибридизации АО в молекуле метана, полученные нами на основе расчетов в приближении полного пренебрежения дифференциальным перекрыванием. В табл. 6 приведена одноэлектронная матрица плотности Р для молекулы метана, равновесная геометрия и ориентация в пространстве которой определяются данными табл. 7. Вычислим двухцентровую МО, локализованную на связи С-H1. Для этого выделим из матрицы Р блок, соответствующий орбиталям атома углерода и атома водорода H1:

и приведем его унитарным преобразованием к диагональному виду
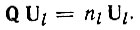 (4.44)
(4.44)
Таблица 7. Декартовы координаты атомов в молекуле метана,Ао
Собственные значения nl равны 2,000; 1,150; 1,009; 1,009; 0,000. Таким образом, одна из одноцентровых орбиталей, представленная в базисе АО
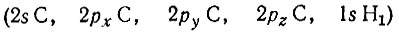
столбцом

оказывается естественной МО, строго локализованной на связи С-Н1 и заселенной двумя электронами. Эту локализованную МО можно записать в виде следующей линейной комбинации базисных атомных орбиталей:

или

где
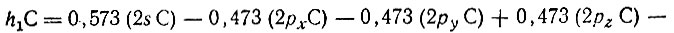
гибридная АО углерода, ориентированная вдоль связи С-Н1, Существенно, что s-характер этой гибридной орбитали равен 33%, что соответствует sр2-гибридизации атома углерода и явно противоречит распространенному в химической литературе мнению о sp3-гибридизации углерода в метане и других насыщенных соединениях. Такое противоречие является следствием того что метод проектирования приводит к неортогональным наборам локализованных МО и гибридных АО, в то время как в теоретической химии обычно используется понятие об ортогональных орбиталях. Ортогонализация неортогонального набора четыоех эквивалентных гибридных АО hiC по методу Лёвдина приводит в рассматриваемом случае (СН4) к четырем ортогональным эквивалентным гибридным АО, которые идентичны гибридным АО углерода в метане, полученным из соображений симметрии. Вместе с тем следует отметить, что завышенный s-характер неортогональных гибридных АО углерода не является случайным. Как повышенная заселенность 2s-орбитали углерода в метане (1,2 против 1,0 для каждой из 2р-орбиталеЙ) он отражает "энергетическую предпочтительность" 2s-орбитали углерода по сравнению с его 2р-орбиталыо. В связи с этим уместно привести потенциалы ионизации свободного, т. е. химически не связанного, атома углерода, соответствующие его валентным орбиталям. Для 2s22p2-конфигурации I2s = 16,6 эВ и I2p = 12 4 эВ; для 2s2p3-конфигурации I2s = 24,7 эВ и I2p = 12,4 эВ.
Существенно для понимания особенностей метода проектирования то, что в отличие от обсуждавшихся ранее методов этот метод не приводит к смешиванию МО σ- и π-типа локализованных на кратных связях, например, в молекулах N2, CO, BF, C2H2 и C4H4. Однако вычисленные методом проецирования локализованные МО σ- и π-типа могут быть переведены дополнительным унитарным преобразованием в эквивалентные банановые МО аналогичные тем, которые были получены Эдмистоном и Рюденбергом (см. табл. 4.3).
Метод эталонной матрицы плотности. Метод эталонной матрицы плотности был предложен в 1968 г. Мак-Вини и Дель Ре [63] и получил дальнейшее развитие в работе [22].
Следуя Мак-Вини и Дель Ре, допустим, что МО могут быть локализованы в орбитали неподеленных и связывающих электронных пари, возможно, в вакантные орбитали некоторых атомов. Это означает, что каждую локализованную МО можно представить либо гибридной атомной орбиталью (ГАО), либо линейной комбинацией двух ГАО, относящихся к непосредственно связанной паре атомов. Будем предполагать пока, что заселенности этих гибридных АО равны, т. е. связи строго ковалентны. При учете поляризации двухцентровых локализованных связей орбитали неподеленных электронных пар и вакантные АО следовало бы рассматривать как случай предельной поляризации и выделять его особо не имело бы смысла. В силу сделанных допущений одноэлектронная матрица плотности в ортонормированном по методу Лёвдина многоцентровом базисе ГАО состоит из целых чисел 0, 1,2, причем каждой связывающей электронной пара соответствует блок 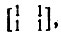 , неподеленной электронной паре - диагональный элемент 2 и остальные элементы матрицы плотности равны нулю. Такая идеализированная матрица плотности называется эталонной.
, неподеленной электронной паре - диагональный элемент 2 и остальные элементы матрицы плотности равны нулю. Такая идеализированная матрица плотности называется эталонной.
Коэффициенты гибридизации, образующие матрицу
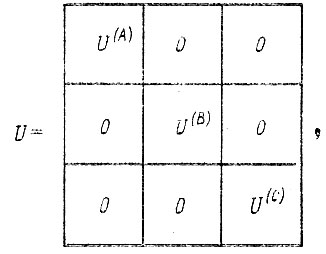 (4.45)
(4.45)где А, В, С, ...- атомы в молекуле и одновременно соответствующие им наборы АО, определялись Мак-Вини и Дель Ре из условия минимума суммы орбитальных энергий
 (4.46)
(4.46)b предположении, что матрица Фока F(P) фиксирована и не меняется при преобразовании U. Однако Eoрб составляет лишь часть полной электронной энергии Eэл, и то обстоятельство, что изменение δEэл совпадает с δEорб в линейном по δР приближении, не может служить обоснованием критерия Мак-Вини и Дель Ре, так как величина Еэл должна быть стационарной относительно варьирования матрицы плотности, и определяюдими для ее изменения следует считать приближения более высокого порядка. В то же время вследствие зависимости F от матрицы плотности и, следовательно, от U точная минимизация Еэл относительно U является довольно сложной задачей.
Более простым в вычислительном отношении является метод, основанный на минимизации (посредством гибридизации АО) :реднеквадратического отклонения заданной в гибридном базисе матрицы плотности Ph от эталонной  [22]. Для его реализации не требуется решения задачи самосогласованного поля при определении локализованных МО и соответствующих им ГАО, если эта задача уже решена в целях определения канонических МО или матрицы плотности. Основанием для такого выбора критерия оптимальности гибридных АО может служить то, что полная электронная энергия молекулы стационарна относительно малых вариаций одноэлектронной матрицы плотности
[22]. Для его реализации не требуется решения задачи самосогласованного поля при определении локализованных МО и соответствующих им ГАО, если эта задача уже решена в целях определения канонических МО или матрицы плотности. Основанием для такого выбора критерия оптимальности гибридных АО может служить то, что полная электронная энергия молекулы стационарна относительно малых вариаций одноэлектронной матрицы плотности
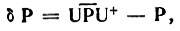 (4.47)
(4.47)т.е.
 (4.48)
(4.48)при условии, что исходная матрица плотности Р вычислена в приближении самосогласованного поля и δР - достаточно малая (в смысле евклидовой нормы ||δP||) эрмитова матрица, определяемая формулой (4.47).
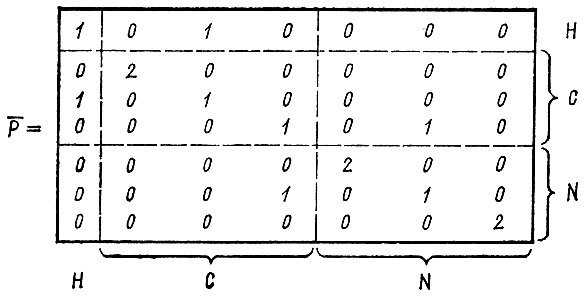
В качестве примера, иллюстрирующего формализм метода эталонной матрицы плотности, рассмотрим локализацию МО σ-типа в молекуле HCN. Предполагая, что в этой молекуле имеется одна неподеленная электронная пара, две остовные орбитали и две двухцентровые орбитали σ-типа, реализующие ковал ентные связи НС и CN, эталонную матрицу плотности записывают в виде
Исходная матрица плотности, вычисленная по методу МО, в ортонормированном базисе сферических АО
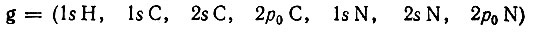
существенно отличается от 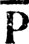 :
:

Однако преобразованием гибридизации АО базиса g:
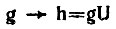 (4.49)
(4.49)и его ортогонализацией:
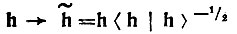 (4.50)
(4.50)можно добиться того, что по отношению к новому базису
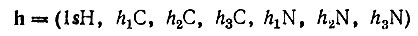 (4.51)
(4.51)матрица плотности примет вид

В отличие от исходной матрицы Р матрица Ph может аппроксимироваться эталонной матрицей 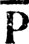 . Последняя отвечает строгой локализации МО, которые в ортонормированном (по Лёвдину) базисе
. Последняя отвечает строгой локализации МО, которые в ортонормированном (по Лёвдину) базисе  представлены столбцами матрицы
представлены столбцами матрицы
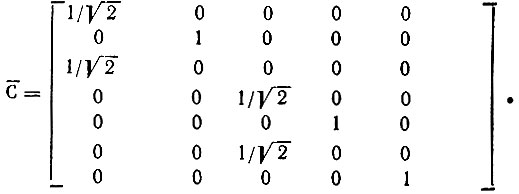
Виртуальные МО также могут быть локализованы, причем каждой занятой связывающей МО
 (4.51)
(4.51)соответствует виртуальная разрыхляющая
 (4.52)
(4.52)Остальные локализованные виртуальные МО являются просто вакантными гибридными АО.
Если исходный набор МО
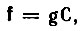 (4.53)
(4.53)
включающий и виртуальные МО, преобразуется в набор 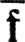 строго локализованных МО (также включающий виртуальные МО) преобразованием
строго локализованных МО (также включающий виртуальные МО) преобразованием
 (4.54)
(4.54)то матрица Т, осуществляющая строгую локализацию исходных МО f, определяется как
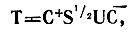 (4.55)
(4.55)где
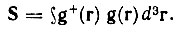
В рассматриваемом примере (HCN) гибридные АО выражаются через исходные сферические АО согласно следующим равенствам:

Из этих выражений видно, что в приближении строгой локализации МО гибридные АО h1C и h1N являются орбиталями электронных пар остова, h3N-ГAO представляет неподеленную электронную пару азота, остальные ГАО образуют МО σ-типа, локализованные на связях НС и CN. Степень локализации МО характеризуется среднеквадратическим отклонением матрицы плотности Рh от эталонной  :
:
 (4.56)
(4.56)
и удвоенной суммой квадратов интегралов перекрывания строго локализованных  с исходными f:
с исходными f:
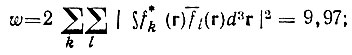 (4.57)
(4.57)ω не может превосходить числа электронов N (в рассматриваемой системе ω< 10), и локализация будет тем точнее, чем ближе значения ω и N.
Метод эталонной матрицы плотности обобщается для случаев, когда необходимо учитывать полярность локализованных двухцентровых МО. Такое обобщение можно осуществить при замене в эталонной матрице плотности блоков
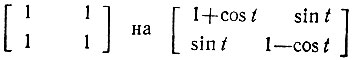
и при определении параметров поляризации t вариационным методом [63]. Строго ковалентным связывающим МО при этом будет соответствовать значение t = π/2, а неподеленным электронным парам и вакантным ГАО - t = 0 или π. Строго говоря, такое обобщение рассматриваемого метода уже не позволяет называть его методом эталонной матрицы плотности. Легко убедиться, однако, что учет полярности связей, как правило, возможен и с фиксированной эталонной матрицей 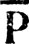 , т. е. результаты ее вариационного определения могут быть предсказаны заранее. При этом для ГАО неподеленных электронных пар (hl)
, т. е. результаты ее вариационного определения могут быть предсказаны заранее. При этом для ГАО неподеленных электронных пар (hl)  ll = 2, Для вакантных ГАО (hi)
ll = 2, Для вакантных ГАО (hi) 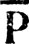 ii = 0, а для валентных ГАО ha и hb, образующих локализованную
ii = 0, а для валентных ГАО ha и hb, образующих локализованную  ab, эталонные заселенности
ab, эталонные заселенности 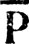 aa,
aa, 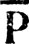 bb и порядки связей
bb и порядки связей 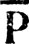 ab определяются равенствами
ab определяются равенствами

и условием инвариантности атомных зарядов относительно гибридизации АО.
Коэффициенты разложения строго локализованных МО по ортогонализованным ГАО выражаются через их заселенности по формулам

Для молекулы HCN заселенность 1s-орбитали водорода равна 0,855 и, следовательно, заселенность гибридной АО углерода h2C равна 1,145. Так как сумма заселенностей всех σ-орбиталей углерода составляет 4,099, заселенность его h3С-ГАО равна 0,954. Определяя теперь порядки связей (недиагональные элементы матрицы Р) как среднегеометрические значения соответствующих заселенностей (диагональных элементов матрицы 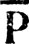 ), получаем
), получаем
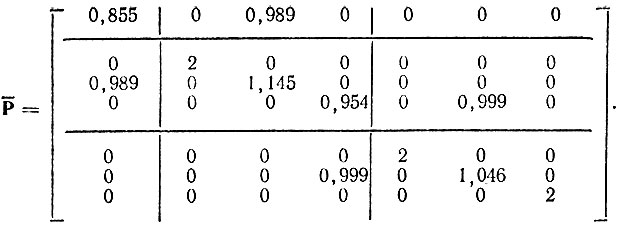
Вычисления свидетельствуют, что при учете полярности локализованных МО матрица Рh остается практически неизменной. Коэффициенты гибридизации также почти не меняются. В то же время максимум ω повышается до 9,98 (w ≈ 10), а минимум θ понижается до 0,25. Таким образом, учет полярности локализованных МО заметно улучшает аппроксимацию "точной" матрицы плотности Рh эталонной матрицей 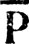 , хотя и является несущественным для определения характера гибридизации АО.
, хотя и является несущественным для определения характера гибридизации АО.
Метод эталонной матрицы плотности допускает обобщение на системы с многоцентровыми связями [22]. Типичным примером химического соединения ОМ, которого нельзя локализовать исключительно в одноцентровые и двухцентровые МО, является молекула диборана В2Н6 (рис. 19). Два из шести атомов водорода в этой молекуле имеют по два равноотстоящих соседних атома (B1 и В2). Каждый из атомов бора, в свою очередь, связан с четырьмя атомами водорода. Следует учитывать также возможность непосредственного химического взаимодействия атомов бора друг с другом.
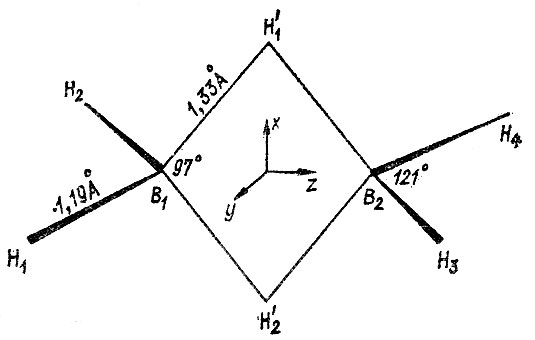
Рис. 19. Молекула диборана
"Внешние" связи ВН в диборане, очевидно, реализуются двухцентровыми МО, образуемыми 1s-орбиталями водорода и гибридными АО бора. Еще не зная конкретного вида этих ГАО (h), можно определить их заселенности 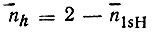 по известным заселенностям
по известным заселенностям 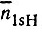 =n1sH. Предположим далее, что две другие валентные МО локализуются на трехцентровых связях B1H1'B2 и B1H2'B2 и что каждая из них образована 1sH'i орбиталью водорода и гибридными АО бора hi1' и hi2' причем
=n1sH. Предположим далее, что две другие валентные МО локализуются на трехцентровых связях B1H1'B2 и B1H2'B2 и что каждая из них образована 1sH'i орбиталью водорода и гибридными АО бора hi1' и hi2' причем
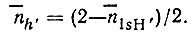
Таким образом определяются диагональные элементы эталонной матрицы плотности ( ). Недиагональные элементы
). Недиагональные элементы 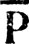 ab, как было показано в работе [22], могут быть вычислены как геометрические средние значения диагональных элементов независимо от того, каким связям (двухцентровым или трехцентровым) они соответствуют.
ab, как было показано в работе [22], могут быть вычислены как геометрические средние значения диагональных элементов независимо от того, каким связям (двухцентровым или трехцентровым) они соответствуют.
Росле того как построена матрица  , максимизацией ω(4.57) вычисляются оптимальные ГАО бора В1:
, максимизацией ω(4.57) вычисляются оптимальные ГАО бора В1:
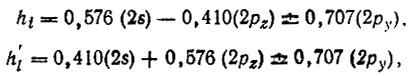
и ГАО атома В2, отличающиеся от указанных лишь знаком коэффициента при 2pz-орбитали.
Гибридные АО бора h1 и h2, ориентированные к периферийным атомам водорода H1 и Н2, образуют угол 120°; угол h'j-орбиталями, ориентированными к мостиковым атомам водорода H'j, существенно меньше и составляет 102° (ср. с углами на рис.19).
Интересный елучай представляет молекула циклопропана, особенностью которой, отличающей ее от молекул большинства других органических соединений, является аномально-малый угол между связями С-С. Три атома углерода в циклопропане образуют правильный треугольник с углами в 60°, что существенно меньше обычных значений 109,5° для насыщенных и 120° для сопряженных ненасыщенных соединений (рис. 20).
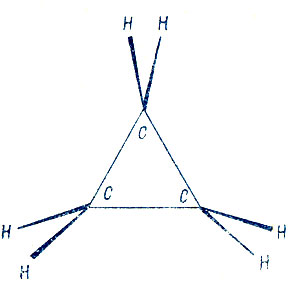
Рис. 20. Молекула циклопропана
Для описания структуры химической связи в циклопропане были предложены две модели. Согласно модели Коулсона и Моффита [36], в циклопропане реализуются три локализованные двухцентровые двухэлектронные связи углерод-углерод. Образующие эти связи гибридные АО ориентированы навстречу друг другу, но не строго по линии С-С, а под некоторым углом к ней (рис. 21). Из условия ортогональности вещественных гибридных АО следует, что этот угол не может быть меньше 15°. Особые химические свойства циклопропана, близкие к свойствам алкенов (хотя он относится к насыщенным углеводородам), объясняются в рамках модели Коулсона и Моффита тем, что "банановые" МО циклопропана подобны эквивалентным банановым МО, которые получают - π-типа в алкенах.
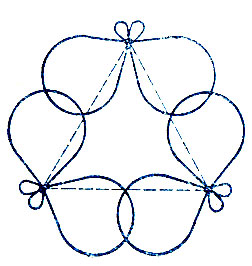
Рис. 21. Модель Коулсона и Моффита для молекулы циклопропана
Согласно модели Уолша [84], в циклопропане реализуются две трехцентровые межуглеродные связи, одна - двухэлектронная, а другая - четырехэлектронная (рис. 22). Двухэлектронной связи соответствует полносимметричная трехцентровая МО, четырехэлектронной - две вырожденные МО, образованные "чистыми" 2р-орбиталями углерода и преобразующиеся по двумерному неприводимому представлению группы симметрии молекулы D3h).
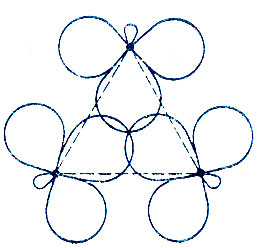
Рис. 22. Модель Уолша для молекулы циклопропана
Метод эталонной матрицы плотности позволяет сравнить качество альтернативных моделей и вычислить отвечающие им коэффициенты гибридизации АО углерода. Вычисленный s-xaрактер ГАО, реализующих двухцентровые углерод-углеродные связи в модели Коулсона и Моффита, χs = 18%, и вычисленное значение угла между этими ГАО (принадлежащими общему атому углерода) равно 102°, что означает их отклонение на 21° от линии, связывающей атомные ядра. Гибридные АО, реализующие трехцентровые двухэлектронные связи в модели Уолша, определяются значением χs = 35% и ориентацией к центру молекулы циклопропана. Наконец, гибридные АО, реализующие углерод-водородные связи, как свидетельствуют вычисления, почти не зависят от выбора модели и ориентированы вдоль линии С-Н.
Погрешности, вносимые в одноэлектронную матрицу плотности молекулы циклопропана локализацией МО, характеризуются величинами:

Таким образом, модель Коулсона-Моффита, предполагающая более высокую степень локализации МО, не уступает по точности модели Уолша и даже несколько превосходит ее. Однако различие в точности рассматриваемых моделей достаточно мало, и ни одну из них нельзя считать ошибочной.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'