
Энзим в рабочей спецовке

Энзим в рабочей спецовке
В одной из предыдущих глав уже подробно разбиралось, как на Земле сначала, появились первые органические соединения, как родилась первая прапрапрабактерия. Из одноклеточных получились многоклеточные, рыбы - из простейших, земноводные - из рыб, млекопитающие - из земноводных...
Эволюционная теория Дарвина наглядно и просто объясняет, как высшие организмы получались из низших, как дивергенция и естественный отбор породили сложную и многообразную систему живых организмов на Земле. Но все-таки что такое жизнь?
Марксистско-ленинского определения: "Жизнь - есть форма существования белковых тел" - никто не оспаривает. В последние годы однако ученые рассуждают о кремниевой основе живого вещества, о кристаллической "жизни", о кибернетической, даже о лучистой... Элементарный расчет показывает, что молекулярная, белковая форма на углеродной основе имеет неоспоримые преимущества. Прежде всего это связано с уникальным положением углерода в периодической системе элементов. Нет никаких оснований ограничивать действие менделеевской таблицы нашим ближайшим космическим окружением. Наиболее вероятно, что она универсальная для всей Вселенной. Но тогда и способность атомов углерода образовывать полимерные цепочки, циклы, разветвленные структуры и т. п. также универсальна и уникальна во Вселенной. Неспроста те два полимера, которые удалось обнаружить в космическом пространстве на немыслимых удалениях от Земли - полиоксиметилен и полиацетилен, имеют то же химическое строение, что и на Земле. Законы природы едины.
Теперь возьмем только малую часть углеродных полимерных соединений - белки. По современным химическим представлениям их макромолекулы построены из элементарных звеньев аминокислот. Сейчас известно несколько десятков аминокислот, входящих в состав тех или иных белков. Из них для живых организмов незаменимыми считаются 20 аминокислот. Ограничимся десятью, будем рассматривать только белки, построенные из этих аминокислот.
В одной макромолекуле белка от 1000 до 1000000 таких кирпичиков. Примем в среднем, что их 10000. Мы опять преуменьшаем возможности живых организмов, но посмотрите, что из этого получается. Даже из такого ограниченного, преуменьшенного набора можно построить 1010000 разных молекул белков! Число, фантастическую величину которого даже трудно осознать. Во всей Солнечной системе меньше атомов. Вряд ли их хватит и во всей нашей Галактике, чтобы построить хотя бы по одной макромолекуле всех возможных белков. А ведь мы ограничились только десятью аминокислотами, известно их много больше, а могут существовать сотни. Так что белковая основа дает воистину безграничные возможности сотворения жизни. Возможности, которые могут привести не только к совершенно разнообразным и разнородным формам, но даже и к несовместимым. Но это уже разговор из другой области - о контактах. Вернемся на Землю. С богатствами возможностей белковой жизни не могут тягаться никакие спекулятивные альтернативы. А ведь в одной-единственной клетке никак не меньше чем 1010 молекул. И не только белковых. Тут и мембранные липиды, и нуклеиновые кислоты - хранилище информации, и энергетические резервы в гликогене и аденозинфосфатах, и ферменты, и витамины, и т. д.
Говорят, высшее достижение современной радиоэлектроники - интегральная схема: в одной спичечной головке тысячи элементарных ячеек! Действительно, вещь поразительная и замечательная. Но, между прочим, не стоит забывать и о том, что в нервных центрах любой блохи десятки миллионов нервных клеток, и каждая из них сложнее и действеннее всех интегральных схем, вместе взятых.
Теперь заглянем внутрь живой клетки. Самый интересный и самый загадочный ее компонент - белки. Они и конструкционный элемент, они и регулятор обмена веществ, они и... Все роли белков в жизни живой клетки пока еще не выяснены. Нуклеиновые кислоты - носитель и хранитель информации - взаимно-однозначно связаны с белками. На каждое аминокислотное звено К белка приходится трехзвенный участок нуклеиновой кислоты. О липидах - ближайших родственниках углеводов - много писалось в связи со строением клеточных мембран, оболочек. Они охраняют жизнь от внешних воздействий, изолируют ее от переменчивой окружающей среды, помогают создать постоянную внутреннюю среду. Их роль для возникновения и стабильности жизни бесспорна.
Но уж если заглядывать внутрь клетки, волей-неволей надо поинтересоваться метаболизмом, т. е. обменом веществ, поговорить о тех химических процессах, которые и составляют суть жизни. При этом нас будет интересовать не только обмен материальных частиц, движение молекул вне и внутрь клетки, их реакции и прочие превращения, но и то, какие энергетические изменения при этом происходят.
Природа, как известно, экономна. Из огромного числа потенциальных возможностей для каждого явления или процесса она отбирает самые надежные, самые устойчивые, а потом пользуется ими в самых различных случаях. Вот и для сотворения жизни отобрано совсем немного вариантов, а повторяются они чуть ли не во всех живых организмах - от амебы до кита, от лишайника до человека. Основа жизни - живая клетка. Чтобы быть стабильной, чтобы противостоять разрушающим внешним воздействиям, клетка ограждена мембранной оболочкой, а внутри этой оболочки клетка постоянно обновляет свой химический состав, воспроизводя его в тех же формах, что и прежде. Это, так сказать, не статическое, а динамическое постоянство содержания и формы. А для этого клетке нужен источник энергии: или внутренний аккумулятор, сопряженный с химическим генератором, или система усвоения и накопления лучистой энергии. Надо признать, что на первых стадиях биологической эволюции на планете Земля живое вещество имело больше приспособительных механизмов усвоения и накопления энергии. Немногие реликтовые животные и растения, например синезеленые водоросли, ведут себя совсем не так, как современные высшие организмы, которые пользуются относительно небольшим набором реакций. Зато современные высшие организмы умеют "выжимать" из него максимум пользы. Даже одноклеточные водоросли - наши отдаленные предки - знают как и умеют присваивать, накапливать и переносить энергию значительно большим числом способов, чем мы с вами.
Кстати, именно разнообразие способов, применяемых микроорганизмами, позволяет высшим организмам ограничиваться узким арсеналом. Высшие, как правило, не создают энергии, не занимаются трансформацией иных форм - лучистой, тепловой и др. - в химическую. Он растрачивает запасы, накопленные низшими.
В общем, можно систематизировать все способы накопления энергии, используемые в живой природе, в три типа: фотосинтез, дыхание и брожение. Разнообразие вариантов поразительно, но итог всегда одинаков: электрон постепенно или сразу переносится в живом организме от донора к акцептору электронов. Энергия, выделяющаяся при таком переносе, используется организмом в процессах жизнедеятельности. В химии такой перенос электрона называется окислительно-восстановительной сопряженной реакцией. Для жизни имеют существенное значение два типа таких реакций: те, которые идут на свету, главным образом с использованием солнечного света, и называются обычно органическим фотосинтезом, и те, которые идут в темноте. С некоторой натяжкой эти два типа соответствуют делению живого мира на растительное и животное царство, хотя к последнему тогда придется приписать и почти все микроорганизмы.
В свою очередь, окислительно-восстановительные реакции существуют в трех вариантах: дыхание, анаэробное дыхание и брожение. В первом случае акцептором электрона служит кислород, во втором - какое-нибудь иное неорганическое вещество, в третьем - подходящее органическое вещество. Высшие организмы на Земле, в том числе и автор и читатель, добывают энергию для своего существования исключительно с помощью дыхания. Анаэробное дыхание и брожение остаются уделом микроорганизмов. Растения, как мы уже выяснили, занимаются в основном фотосинтезом. В частности, поэтому даже выдвигалось предложение делить живое на Земле не на два, а на три царства. И во всех - двух или трех - царствах накопление энергии, строительные и ремонтные работы, обмен веществ и прочие химические реакции в так называемых мягких условиях, т. е. при температурах не выше 50° С, а в большинстве случаев - при 20-30° С, при атмосферном давлении и при сравнительно низких концентрациях реагирующих веществ. Само существование на Земле организмов, способных проводить такие реакции аж при 95-100° С, оказалось сенсационным открытием. Такие организмы, оказывается, существуют в водах дальневосточных гейзеров. Но они - исключение, а все прочие дееспособны в мягких условиях. Но ведь давно известно, что большинство органических реакций в таких условиях идет очень и очень медленно. Именно для повышения скорости техника использует высокие давления, высокие температуры и концентрации. Для живого организма ни то, ни другое, ни третье ужесточение условий проведения реакции неприемлемо. А жить-то надо, жить-то хочется. Вот и пришлось природе изобретать и внедрять в практику четвертый способ повышения скорости химических реакций - добавлять к двум реагирующим веществам катализатор, энзим, или, как его чаще называют, фермент.
Катализатором в химии называют вещество, которое не входит в состав ни исходных, ни конечных продуктов химической реакции, но обязательно присутствует при ? стадии взаимодействия исходных веществ, значительно повышая скорость их взаимодействия. Катализаторы бывают гомогенные и гетерогенные. Первые присоединяются к исходным реагентам, как бы превращают их в более реакционноспособные промежуточные вещества, а после окончания реакции отщепляются от конечных продуктов в неизменном виде и вновь реагируют с исходными. Иногда отщепление катализатора происходит не после реакции, а в ходе ее - этот случай тоже относится к гомогенному катализу. Вторые - гетерогенные катализаторы - в некоторых случаях вообще не вступают в химическое взаимодействие ни с исходными, ни с конечными продуктами, а действуют как адсорбенты, т. е. просто накапливают на своей поверхности смесь реагентов, тем самым резко повышая ее концентрацию и их парциальные давления, что и приводит к ускорению процесса в целом. Но это лишь один из простейших механизмов действия гетерогенных катализаторов. Во многих других случаях механизм их действия сложный и поддается расшифровке лишь после длительной исследовательской работы.
Биологические объекты пользуются исключительно гомогенными катализаторами - энзимами, или ферментами. В настоящее время ученым известно около 1000 природных ферментов. Об их строении и классификации поговорим чуть позже, а сейчас попробуем разобраться в том, как именно удается этим природным катализаторам облегчить течение химических реакций.
Как известно, очень многие пары веществ в окружающем нас мире могли бы вступить во взаимодействие, но почему-то мирно сосуществуют в неизменном виде. Возьмем, к примеру, бензин и кислород. Всем известно, как здорово они реагируют друг с другом. Энергии, выделяющейся при их взаимодействии, вполне хватает, например, для того, чтобы по воздуху перенести нас из Москвы в Сочи и обратно. Но налейте бензин в блюдечко и поставьте его на открытом воздухе. Конечно, позаботившись загодя, чтобы по соседству лежал огнетушитель. Реагенты рядом, а реакции нет. Почему? Чтобы начать взаимодействие, им нужна начальная порция энергии, активирующая взаимодействие, так называемая энергия активации, Еакт. Куда тратится эта энергия? На преодоление энергетического барьера. Чтобы начать взаимодействие, молекулы исходных веществ должны стать активными, перейти в более высокое энергетическое состояние (рис. 7). Одна возбужденная молекула, например, А* встретится с возбужденной молекулой - Б*, реакция начнется немедленно. После реакции продукт А*Б* отдает и энергию взаимодействия, и запасенную энергию активации и переходит в более устойчивое энергетическое состояние АБ. Если реакция экзотермическая, то общее количество выделившейся энергии больше, чем было затрачено на активацию, можно активировать уже по две или по три молекулы А и Б, процесс этот нарастает лавиной. Вот тут вам и потребуется загодя приготовленный огнетушитель. Стоило поджечь бензин в блюдечке спичкой - огонь быстро разросся, мог даже превратиться в пожар. Но пока не было внесено первичной порции Еакт., реагенты мирно сосуществовали: энергетический барьер удерживал их от взаимодействия.
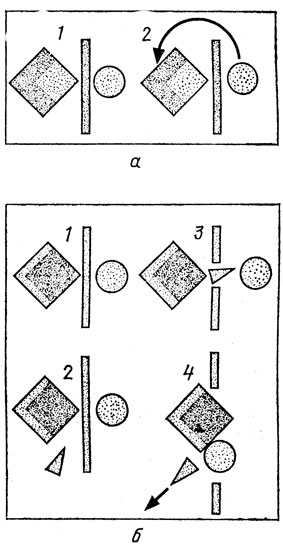
Рис. 7. Чтобы вступить во взаимодействие, две любые молекулы должны преодолеть энергетический барьер (а); проделывая туннель в энергетическом барьере, фермент ускоряет химические реакции в миллионы раз (б): 1 - исходное состояние, молекулы разъединены и не имеют запаса энергии для преодоления барьера; 2 - в работу вступает энзим; 3 - энзим проделывает туннель в энергетическом барьере; 4 - молекулы соединились, энзим отправляется к новой паре реагентов
Что же делает катализатор? Назовем его К. Он вступает в реакцию с А или Б со значительно меньшей энергией активации, столь малой, что для нее достаточны обычные тепловые флюктуации. Промежуточный продукт АК очень легко возбуждается, а его возбужденное состояние, (АК)* далее реагирует с Б. Получается (АБК), выделяется избыток энергии, катализатор отщепляется и остается продукт АБ. Катализатор как бы просверлил тоннель в энергетический барьер и тем резко увеличил скорость реакции. Технические катализаторы, применяемые в химических лабораториях и на заводах, повышают скорости реакций в десятки и сотни раз, а биологические катализаторы - ферменты - в десятки и сотни миллионов раз. Поэтому в технике мы дополнительно ускоряем химические реакции нагреванием (повышение температуры на 10° С увеличивает скорость химических реакций в 2-3 раза). А живое вещество может обходиться и без такого повышения температуры и спокойно существует и функционирует в мягких условиях комфортного земного климата.
Теперь пора поговорить о типах и строении ферментов. Как уже упоминалось, сейчас известно около 1000 ферментов. Запомнить их все трудно даже узкому специалисту-биохимику. Чтобы облегчить себе запоминание, сначала подразделили их все на две большие группы: чисто белковые ферменты и ферменты, состоящие из белка и кофермента. Как видите, практически все ферменты - вещества, содержащие в своем составе белок. Молекулярные веса белковых макромолекул, какие встречаются в составе ферментов, очень различны. Есть совсем небольшие - всего 10 тыс., а есть и миллионеры, что уже близко к белкам конструктивным, белкам мышц, кожи, других тканей. Естественно, что разобраться в точной химической структуре большинства белковых макромолекул ферментов пока еще химикам и биологам не удалось. Лишь для некоторых простейших ферментов, например рибонуклеазы, установлены точно первичная, вторичная и третичная структуры. Это макромолекула, состоящая из 124 аминокислотных остатков; она имеет четыре сульфидных мостика и определенную пространственную конфигурацию (рис. 8). В ферменте химотрипсине установлено, что макромолекула белка состоит из 246 аминокислотных остатков; известен порядок их расположения в молекуле, но недостаточно выяснены вторичные и прочие структуры.
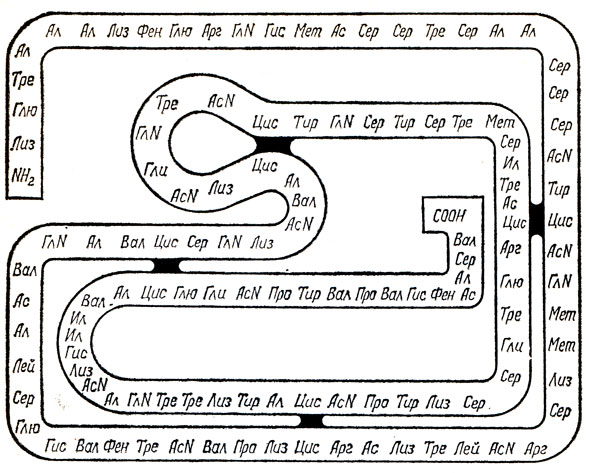
Рис. 8. Первичная структура фермента рибонуклеазы. Черным обозначены четыре дисульфидных мостика, скрепляющих полипептидную цепь
Классификация всех ферментов на две большие группы по их химической структуре все же недостаточно удобна. Во-первых, все равно ферментов слишком много в каждой группе, во-вторых, неясно, что же они могут, как именно действуют. Поэтому несколько лет назад по рекомендации комиссии по ферментам Международного биологического союза были разработаны новая классификация и правила рациональной номенклатуры как всех известных ферментов, так и тех, какие еще будут открыты. В основу этой классификации заложен принцип практической работы фермента: что он может, каким путем этого добивается. В соответствии с таким принципом определены шесть классов рабочих задач, решаемых и выполняемых ферментами. Естественно, что работают они над превращением молекул, поэтому шесть классов ферментов - это шесть типов химических реакций молекул в живых организмах.
Первый класс - ферменты, которые помогают окислять или восстанавливать подотчетные им молекулы. Этот класс назван "оксидоредуктазы". В зависимости от того, какие именно функциональные группы восстанавливаются или окисляются в обрабатываемых молекулах, класс разделен на 14 подклассов. Здесь уместно упомянуть, что все известные ныне ферменты узкоспециализированы: каждый может работать только над какой-нибудь одной молекулой, и производит над ней только одно превращение. Такая узкая специализация, высокая специфичность, избирательность действия - одни из важнейших преимуществ ферментов. Вы можете поместить данный фермент в бульон, где смешаны десятки различных веществ, он будет работать только с одним и только одну реакцию для него катализировать. Более того, данный фермент будет использовать для этой реакции только один-единственный другой реагент Б. Это и естественно: ведь ферменты вырабатывались, создавались природой для работы в живых клетках, а там смешаны не десятки, а, может быть, тысячи различных веществ. Если бы ферменты не были так узко специализированы, - они бы в клетках таких дел натворили... Новая классификация учла и эту особенность ферментов. Кроме классов и подклассов, ферменты разбиты по под-подклассам в зависимости от второго реагента. В случае оксидоредуктаз, например, под-подклассы позволяют учитывать, кому именно передается электрон, отобранный у молекулы А. Класс, подкласс, под-подкласс и сам фермент перенумерованы, и если шифр фермента 1.7.2.5 - это значит, что он относится к первому классу, оксидоредуктаз, работает только над аминогруппами, передает электроны кислороду, и это пятый из известных ферментов, обладающих способностью катализировать такие реакции.
Второй класс ферментов - трансферазы - занимается исключительно переносом от одного вещества к другому фосфатной, аминной, метильной, ацетильной и других групп.
Третий класс - гидролазы - омыляет, т. е. гидролизует либо эфирные, либо аминные и амидные группы. О ферментах этого класса у нас еще будет особый разговор, ибо они первыми нашли широкое практическое применение вне живых организмов.
Четвертый класс - десмолазы, они же лиазы, - работает над тем, чтобы отщепить от вещества молекулу или присоединить к нему; сюда относятся негидролитические реакции с водой и углекислотой. Отдельный подкласс этого класса работает над разрывами С-С-связей.
В пятый класс включены все изомеразы, чья задача - перестраивать молекулы, не изменяя их химического состава, но передвигая с одного места на другое отдельные атомы и целые группы атомов.
И наконец, ферменты последнего, шестого класса - лигазы, или синтетазы, - катализируют соединение двух молекул, сопряженное с расщеплением пирофосфатной связи в молекуле аденозинтрифосфорной кислоты или аналогичного фосфата. Как ни кажется это странным, этими шестью классами с соответствующим количеством под-подклассов ограничивается все множество всех химических реакций, происходящих в живых организмах. Как видим, природа действительно экономна. Хотя это можно объяснить тем, что в ходе многомиллионнолетней эволюции отобрались лишь самые эффективные реакции, тот, казалось бы, небольшой набор, который и обеспечивает устойчивость жизни на Земле, Природе, чтобы создать и отсортировать эту тысячу реакций, потребовались миллионы лет (может быть, и миллиарды). Биохимикам, чтобы разобраться в этом, потребовалось два века.
История ферментов начинается... собственно говоря, тогда же, когда начинается история жизни на Земле. Без ферментов, без их огромной каталитической активности и столь же поразительной селективности жизни просто не существовало бы в современном понимании этого термина "Жизнь". Можно с уверенностью сказать, что и целенаправленное практическое использование ферментов человеком началось тоже в незапамятные времена. Заквашивание теста, брожение пивного и винного сусла, выделка кож и меха - неизвестно, кто и когда впервые на Земле занялся этими ферментативными технологическими процессами. А вот осмысленный, научный подход к ферментативным процессам следует отсчитывать лишь с начала XIX в. В 1814 г. русский химик К. Г. Кирхгоф открыл ферментативное действие водной вытяжки солода на расщепление крахмала до сахара. По нынешней терминологии он обнаружил действие фермента из класса гидролаз. В 1833 г. французы А. Пайен и Ж. Персо выделили из солода препарат фермента амилазу, осуществляющего сбраживание сахара до спирта и углекислоты. Лишь много позже выяснилось, что амилаза - смесь по меньшей мере полдюжины ферментов, каждый из которых проводит одну стадию этого сложного процесса. Но в те годы существование и действенность ферментов в виде водных растворов, а не только в составе живых клеток было событием революционно-научным. Тут мы сталкиваемся с одним из величайших научных открытий и одним из величайших научных заблуждений середины XIX в. Речь идет о работах Луи Пастера и о его дискуссии с Ю. Либихом, П. Э. М. Бертло и К. Бернаром.
Следующий шаг, гениальный для микробиологии и чуть было не ставший роковым для биохимии, сделал француз Каньяр де ла Тур в 1837 г. Именно он выяснил, что спиртовое брожение сахара - дело дрожжевых грибков. Немного позже Луи Пастер открыл культуры микроорганизмов, способных проводить молочнокислое, маслянокислое и иные виды брожения. У П. де Круи подробно описано, как именно Пастер пришел к этому открытию, выполняя заказ-просьбу лилльских виноделов. В красочных деталях этого описания затерялась ошибка Пастера. Он утверждал, что брожение вызывают и от начала до конца проводят существа. Теперь мы знаем, что этим занимаются вещества - ферменты. Оппоненты Пастера в те годы не могли выделить эти вещества в чистом виде - это и сегодня не всякому по силам даже при использовании сложнейшей современной лабораторной техники. Полвека шла эта дискуссия, пока в 1897 г. Э. Бухнеру не удалось выделить фермент зимазу в таком чистом виде в растворе, где ни о каких клеточных структурах (а значит, и ни о каких существах) и речи быть не могло. А еще через 30 лет американцы Дж. Самнер и Дж. Нортроп получили ферменты уреазу и пепсин в кристаллическом виде. Тем самым была поставлена точка в споре виталистов с биохимиками.
Почти два века потребовалось, чтобы разобраться в основах ферментативного катализа. Сегодня мы знаем, что ферменты очень активны и специфичны. Мы знаем, что они боятся нагрева (белок сварится - катализатор погиб), что каждый фермент хорошо работает только при своей характерной кислотности среды. Мы сумели дать им почти 1000 названий, сумели расклассифицировать по предназначенным для них субстратам и способам действия. Мы научились выделять некоторые ферменты в чистом и даже в кристаллическом виде. Мы установили первичную, вторичную и третичную химическую структуры некоторых ферментов и даже начали понимать, как именно они действуют. Пройдет еще лет сто-полтораста, научимся очищать и остальные ферменты, установим их структуры, даже научимся синтезировать их, выращивать в колбах и пробирках. А зачем?
Конечно, приятно сознавать, что ты понимаешь, что такое жизнь, знаешь, как именно работают твои клетки и молекулы внутри клеток. И не только твои, но и всех живых существ на свете. Но не только ради понимания трудились ученые. И для регулирования тоже. Скажем, к примеру, знаем ли мы, как именно действуют на человека яды и просто вредные вещества? Оказывается, многие из них дезактивируют наши ферменты, ингибируют их работу. Понимая, как произошло ингибирование, легче придумать, как его устранить, как и чем лечить отравившегося человека. Более того, даже без внешних ядов ферменты в нашем организме иногда отказываются работать, хотя бы из-за слишком высокой концентрации питательных веществ. Знание структуры ферментов, понимание механизма их действия опять-таки может улучшить нашу с вами жизнь.
А иногда полезным оказывается и противоположное знание: как "выключить" тот или иной фермент. Скажем, к примеру, фермент, какого нет в человеческом организме, но который необходим для жизнедеятельности инфекционного микроба. Именно на ферментные нарушения деятельности бациллы Коха, дизентерийной палочки, некоторых других микробов нацелены такие лекарства, как фтивазид, энтеросептол, стрептоцид и др.
Но регулирование процессов в живом организме - только одна из задач, неразрешимых без глубоких знаний о ферментах. Другой круг задач - те самые древнейшие профессии, которые связаны с использованием ферментативных превращений веществ. Хлебопечение, квашение овощей и фруктов, сыроварение, виноделие и пивоварение, производство чая и табака и другие виды производств, использующих стадию ферментации, до сих пор обходились природными, грибковыми или бактериальными источниками ферментов. Можно надеяться, что уже в недалеком будущем биохимическая промышленность сможет поставлять на хлебозаводы и в сыроварни бочки кристаллических ферментов, более чистых и более активных, чем те, которые производятся капризными микробами. Кстати, в производстве лекарств наметился сдвиг к использованию чистых ферментов вместо чересчур нежных и деликатных микроорганизмов. И для сельского хозяйства ферменты могут оказаться не просто полезными, а даже необходимыми. Ведь, к примеру, усвоение растением минеральных удобрений, первооткрывателем которых был еще Ю. Либих, невозможно без предварительного ферментативного превращения этих удобрений. Хорошо, если в почве есть подходящие микроорганизмы. В частности, мочевина сама по себе не усваивается растениями. Сначала она под действием фермента уреазы должна превратиться в аммиак и углекислоту, а потом уж будет усвоена растением.
Ферменты, оказывается, могут быть полезны не только при производстве микстур и таблеток, но и при лечении человека в стационаре. Всем известно, что большинство вредных веществ выводится из нашего организма через почки. А если собственные почки откажут, можно применить аппарат "искусственная почка". Основной метод очистки крови в этом аппарате - с помощью мембран. Но не все вещества способны проникать через мембрану. Желательно загодя измельчить их. В этом могут существенно помочь чистые ферменты. Но вот беда: сами-то ферменты растворимы в воде, они будут вымываться через ту же мембрану. Чтобы заставить каждую молекулу фермента работать в "искусственной почке" как можно дольше, пришлось прикрепить фермент к внутренней поверхности мембраны с помощью химических связей. Такая фиксация называется иммобилизированным ферментом. В частности, разработана технология получения и применения в "искусственной почке" полиуретана с иммобилизированным ферментом, освобождающим кровь от ревматоидартритного фактора. Обработка ферментами других полимеров позволяет смягчить или ужесточить, упрочнить или ослабить, уплотнить или разрыхлить полимерные материалы, используемые для изготовления искусственных кровеносных сосудов, сердечных клапанов и т. п. протезов.
Конечно, для каждого полимера и каждого изделия приходится подбирать свой обрабатывающий состав, свой режим и т. д., но это уж, как говорится, дело техники. Легче всего такому воздействию поддаются целлюлозные пластики и волокнистые материалы. Оно и не удивительно, ведь целлюлоза - самый распространенный в природе и едва ли не самый древний полимер, и большинство ферментов к ней давно уже привыкло. Под действием ферментов удается не только модифицировать свойства изделий из целлюлозы, но и превращать ее в кристаллическую глюкозу с помощью ферментов класса гидролаз. Либо, наоборот, сохранять всю целлюлозу в целости и сохранности, очищая ее от всяческих примесей и загрязнений. В частности, именно ферментативное разложение лигнина - одна из основных стадий процесса производства целлюлозы из багассы. В бытовой химии разное отношение ферментов к целлюлозе и к протеинам или жирам проявляется в высокой эффективности новейших типов стиральных порошков. Например, в Японии недавно разработан способ стирки хлопчатобумажных тканей и изделий из них с помощью фермента протеазы. Потовые загрязнения на воротничках удаляются при 40° С за несколько минут. Между прочим, ферментативное разложение белков и полипептидов (они отличаются, главным образом, молекулярным весом) - технический способ, вполне пригодный для производства и столярного клея, и пищевых (для скота и людей) аминокислот из отходов кожевенного производства. Один из лучших ферментов для этого - стабилизованная панкреаза. Так что ферментативное расщепление белков на аминокислоты можно проводить и в заводском реакторе, а не только в собственном желудке.
До сих пор речь шла о действии ферментов на природные полимеры. К ним природа приспособилась за миллионы лет эволюции. Намного хуже обстоит дело с синтетическими полимерами и материалами из них. Большинство синтетических полимеров в прямом смысле этих слов "не по зубам" ни одному из существующих ферментов, ни одному из микроорганизмов. Потому-то синтетика не гниет, не ржавеет, не сбраживается. Потому-то и вырастают вокруг современных городов монбланы пластмассовых свалок, а в некогда лазурном Средиземном море теперь, что называется, плюнуть некуда - всюду плавают пластмассовые пробки, флаконы, пакеты и коробки, а то и многометровые полотнища. Конечно, через один-два миллиона лет в природе выработаются ферменты, способные разлагать и полиэтилен, и полистирол, и поливинилхлорид и т. п. Но останется ли в живых природа за это время, не похороним ли мы ее под толщами пластмассового мусора?
Во избежание столь нежелательной перспективы пришлось химикам-синтетикам изыскивать способы, как сделать современные синтетические полимерные материалы ферменторазлагаемыми. Простейший способ изобрела японская фирма "Район юси": полимер смешивают перед формованием изделия с 40-70% питательной среды для бактерий - крахмала, казеина, маннита, лактозы и т. п. Когда изделие отслужит свой срок и попадет на свалку, ферменты помогут "выедать" питательную среду. Оставшийся полимер рассыплется в порошок и будет не так заметен. Но это, конечно, полумера. Порошок-то никуда не денется, будет очень медленно разлагаться под действием озона и солнечного света, а с годами слой такого порошка может оказаться очень и очень толстым.
Другой путь - создание полимеров, в макромолекулярные цепи которых встроены "съедобные" для микробов звенья. Или таких, которые более чувствительны к свету и разлагаются с образованием "съедобных хвостов". Тут уже оставшийся порошок будет иметь молекулярные размеры - значит, и замусоривать планету станет меньше. А функциональные группы по концам цепей ускорят разложение. Полимерами такого типа могут стать, например, те, что описаны в главе "Бездонное месторождение".
Третий путь - приспосабливать не полимер к существующим ферментам, а ферменты к существующим полимерам. Создавать новые ферменты, а тем более бактериальные штаммы - вряд ли перспективное дело. А вот обревизовать то, чем уже богата природа, выявить, отобрать и размножить такие ферменты, такие колонии микробов, которые все же способны питаться синтетическими полимерами, - задача вполне реальная. Болгарские ученые М. Наумова и Ал. Тошков в 1978 г. доказали это прямым экспериментом. Они проверили 75 бактериальных штаммов на действенность по отношению к различным полимерам. Из этого числа удалось отобрать всего два штамма, способных к биоразложению полиакрилонитрила. Теперь осталось выяснить, какой именно фермент позволяет микробам расправляться с полимером. Потом можно будет научиться производить этот фермент, добавлять его понемногу к изделиям из полиакрилонитрила и налаживать их массовое производство, не опасаясь, что из них станет вырастать свалочный Монблан. Более того, при наличии таких ферментов можно будет превращать в питательный перегной все городские свалки мира. Но это - дело будущего.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'