
Глава I. Некоторые свойства жидких систем
1. Давление насыщенного пара индивидуальных жидкостей
Для целого ряда расчетов, связанных с ректификацией, в особенности при проведении различного рода вакуум-перегонок и разгонок, необходимо знать, как изменяется температура кипения вещества с изменением давления1, 2, 3, 4.
Чистое жидкое вещество закипает, когда давление насыщенного пара жидкости становится равным внешнему давлению. Поэтому температура кипения индивидуального жидкого вещества однозначно определяется давлением его насыщенного пара над жидкостью. На рис. 4 показана кривая зависимости давления пара от температуры для н-гептана. Из этого рисунка видно, что состояние жидкости, например н-гептана, при данной температуре характеризуется одним определенным давлением насыщенного пара*, и наоборот, при данном давлении пара температура жидкости может иметь только одно определенное значение.
* (В дальнейшем "давление насыщенного пара" мы будем обозначать термином "давление пара".)
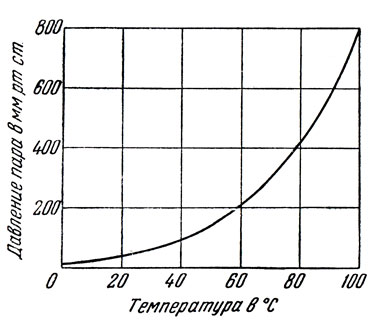
Рис. 4. Кривая зависимости давления пара н-гептана от температуры
Для идеальной жидкости математическую зависимость между давлением насыщенного пара и температурой можно найти с помощью уравнения Клаузиуса-Клапейрона. Если принять, что пар подчиняется законам идеальных газов и скрытая теплота испарения не изменяется с температурой, то эту зависимость можно выразить уравнением
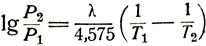 (1)
(1)где Р1 и Р2 - давление пара соответственно при температурах Т1 и T2,
λ - скрытая теплота испарения.
Поведение реальных жидкостей, однако, не вполне соответствует уравнению (1), особенно в широком интервале температур и давлений. Зависимость давления пара этих жидкостей от температуры имеет сложный характер. Поэтому при работе с жидкостями, отличающимися от идеальных, лучше пользоваться не вычисленными, а опытными данными, имеющимися в соответствующих справочниках (см. литературу12-18, 20, 23, 24) или приведенными в оригинальных работах (см., например,37). При отсутствии нужных сведений интересующую нас зависимость приходится вычислять с различной степенью точности, пользуясь каким-либо из многочисленных уравнений, предложенных для этой цели. Критический разбор некоторых из них сделан советскими учеными Трегубовым3 и Киреевым35 (см. также16, стр. 33). Киреев вывел уравнение, с помощью которого можно определить давление пара жидкости А при разных температурах, пользуясь найденной экспериментально температурной зависимостью давления пара другой "стандартной" жидкости В:
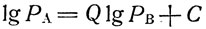 (2)
(2)где РА и PB - давление паров жидкости А и В при одинаковой температуре.
Коэффициенты Q и С уравнения (2) легко найти, зная давление исследуемой жидкости А, хотя бы при двух температурах, или температуры кипения, хотя бы при двух давлениях, в том числе при атмосферном. Тогда:
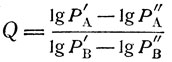 (3)
(3)и
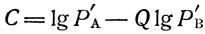
где Р'А и Р'В - давление пара веществ А и В при температуре Т1;
P''A и P''B - давление пара тех же веществ при температуре Т2.
Подставляя в уравнение (2) найденные по двум точкам величины констант Q и С, получаем:
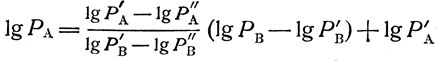 (4)
(4)Если для "стандартного" вещества В, по которому вычисляют РА, температурная зависимость давления пара lgРВ=f(Т) известна, то, подставляя ее в уравнение (4), можно написать аналогичное выражение и для вещества А:
lgPA=φ(T)
Точность величин, вычисленных по уравнениям (1) и (4), тем выше, чем ближе между собой по свойствам оба сравниваемых вещества. Поэтому наиболее точные результаты получаются при сравнении изучаемой жидкости с одним из ближайших ее гомологов. При сравнении соединений с открытой цепью, имеющих полярные группы, положение этих групп имеет большее значение, чем строение углеродной цепи. При сравнении углеводородов следует учитывать положение ароматических ядер, кратных связей и неопентильной группировки, оказывающих сильное влияние на свойства углеводородов.
Несколько менее точные, но все же в ряде случаев вполне удовлетворительные результаты могут быть получены, если в качестве "стандартного" вещества для всех полярных жидкостей (спиртов, кислот, аминов и т. п.), взять воду, а для всех неполярных или слабо полярных (углеводородов, эфиров, галоидоалкилов) - н-гексан.
Киреев на основании уравнения (2) построил весьма интересную номограмму (см. приложение I), позволяющую избежать трудоемких аналитических расчетов, не оправдывающих себя из-за относительно малой точности величин, получаемых в результате приближенных вычислений. С помощью номограммы Киреева можно, правда с еще меньшей точностью, чем в предыдущем случае, определять графически зависимость давления пара от температуры жидкости, для которой известна лишь одна температура кипения (большей частью при атмосферном давлении). Номограмма Киреева может быть легко построена в любом масштабе для разных жидкостей и даже, как указывает автор, для смесей.
Как было показано выше, температуры кипения жидкостей изменяются с изменением давления. Между тем атмосферное давление, при котором производится перегонка, редко оказывается равным 760 мм рт. ст. Поэтому для получения сравнимых результатов при перегонках приходится приводить отсчитанные температуры кипения к нормальному давлению, т. е. определять температуру, при которой кипела бы данная жидкость, если бы атмосферное давление равнялось 760 мм рт. ст.
С этой целью при атмосферном давлении, меньшем 760 мм рт. ст., к показанию термометра прибавляют некоторую величину, называемую "температурной поправкой на давление"; при атмосферном же давлении, большем нормального, эту величину вычитают из показания термометра. При незначительном отклонении атмосферного давления от 760 мм рт. ст. температурная поправка (Δpt) на давление определяется уравнением36:
Δpt=K(760-P)T (5)
где Р - давление;
Т - абсолютная температура кипения жидкости;
К - коэффициент пропорциональности, зависящий от природы вещества.
Для большинства углеводородов, галоидоалкилов и простых эфиров коэффициент К в среднем равен 0,00012; для спиртов К=0,00010; для сложных эфиров К=0,00011. Более точные значения К для различных соединений приведены в табл. 1.
![Таблица 1. Значения коэффициента пропорциональности при вычислении температурной поправки. [см. уравнение (5)]](pic/000009.jpg)
Таблица 1. Значения коэффициента пропорциональности при вычислении температурной поправки. [см. уравнение (5)]
При работе с веществами, для которых известна зависимость температуры от давления, незначительно отклоняющегося от 760 мм рт. ст., температурную поправку на давление удобнее определять, пользуясь уравнением
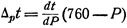 (5a)
(5a)
где 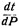 - изменение температуры кипения с давлением, незначительно отличающимся от 760 мм; остальные обозначения те же, что и в уравнении (5).
- изменение температуры кипения с давлением, незначительно отличающимся от 760 мм; остальные обозначения те же, что и в уравнении (5).
В практике ректификации иногда возникает обратная задача: определить, при какой температуре будет перегоняться вещество с известной при нормальном давлении температурой кипения в том случае, если атмосферное давление не равно 760 мм рт. ст. Температурную поправку на давление при этом вычитают из. показания термометра, если давление меньше нормального, и прибавляют, если давление больше нормального.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'