
Фторолефины и их применение
В исследованиях фторорганических соединений наиболее плодотворными оказались работы по изучению фторированных олефинов. Именно они дали возможность организовать производство новых видов пластмасс, смазочных материалов, эластомеров и других веществ, устойчивых к высокой температуре и химическим реагентам. Кроме того, частично и полностью фторированные олефины являются промежуточными продуктами для многих синтезов фторсодержащих веществ - спиртов, эфиров, кислот, сульфидов, нитрилов, амидов и т. п. Но, пожалуй, самым важным является все же использование их в производстве фторопластов и фторэластомеров, где они служат исходными продуктами полимеризации и сополимеризации.
Не менее важным является то, что в результате изучения фторолефинов получено много новых данных о природе кратной связи, влиянии заместителей, механизмах реакций присоединения и полимеризации; эти наблюдения подкрепили и расширили современные представления о сопряжении связей и дали материал для познания механизма многих химических процессов.
Для получения полностью или частично фторированных олефинов в некоторых случаях пригодны способы, используемые в производстве обычных олефинов, но имеется также много специфических способов: декарбоксилирование солей перфторкарбоновых кислот, присоединение перфторалкилиодидов к ацетиленовым соединениям, пиролиз фторуглеродов и другие. Из обычных способов часто используют дегидрогалогенирование.
Дегидрогалогенирование обычно осуществляется воздействием на фторированные соединения, содержащие иной галоген и водород, щелочных агентов или высокой температуры. В качестве щелочных агентов используются гидроокиси и алкоголяты щелочных металлов, третичные амины, в некоторых случаях - фтористый калий, который отнимает HF, превращаясь в KF•HF.
В ряде случаев дегидрогалогенирование осуществляется в паровой фазе (в присутствии катализаторов при повышенной температуре). Например, фтористый винил образуется при пропускании CH3CHF2 над сульфатом магния при 400°С, а винилиден фторид - при пропускании CH3CF2Cl над окисью алюминия при 250-400°С.
Удобным способом получения перфторолефинов является дегалогенирование хлорфторсодержащих углеводородов. Реакция обычно осуществляется в органическом растворителе - с помощью порошка цинка или другого металла.
Дехлорирование низкокипящих фторгалоидалканов происходит при повышенных давлении и температуре. Например, тетрафторэтилен получается из симметричного дихлортетрафторэтана при 110-120°С и 15 ат. Фтористый винилиден СН2 = CF2 образуется из дифтордихлорэтана СН2Cl - CF2Cl также при повышенной температуре.
Для получения частично фторированных олефинов используют присоединение фтористого водорода к ацетилену. Таким способом получается фтористый винил:
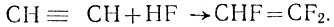
При декарбоксилировании калиевых солей перфгорпропионовой и перфтормасляной кислот образуются соответственно тетрафторэтилен и перфторпропилен: реакция является специфической для фторкарбоновых кислот.
В промышленности важное значение имеет пиролитический метод получения перфторолефинов. При пиролизе дифторхлорметана при 500-600°С с высоким выходом образуется тетрафторэтилен.
При нагревании простейших олефинов до 500-700°С наблюдаются различные пиролитические превращения. Тетрафторэтилен превращается в перфторпропилен, а последний - в перфторизобутилен.
Фторолефины образуются также при пиролизе фторполимеров.
Если фторопласт-4 (политетрафторэтилен) нагревать в вакууме при 500-700°С, в качестве основного продукта получится тетрафторэтилен, а при обычном давлении - смесь его с перфторпропиленом и перфторизобутиленом.
Еще одним методом синтеза фторолефинов служит пиролиз насыщенных фторуглеродов. Например, при нагревании перфторциклобутана при 400-600°С образуется смесь перфгорпропилена, перфторизобутилена и других фторолефинов.
Химические свойства перфторолефинов изучались на протяжении более двадцати лет и раскрыли новые страницы химии. Исследование этик свойств на первых порах имело целью достижение практически важных результатов - полимеризации, теломеризации и многих других. Но по мере углубления в химию перфторолефинов отчетливо проявлялась своеобразная картина их реакционной способности, послужившая темой для многих размышлений.
Оказалось, что по химическим свойствам фторолефины отличаются от незамещенных олефинов, и это своеобразие накладывает определенную печать на свойства их производных.
Фторолефины легко взаимодействуют с нуклеофильными соединениями, образуя соответствующие продукты присоединения. Они реагируют со спиртами, меркаптанами, аммиаком, аминами и бисульфитом натрия. Примером таких реакций служит взаимодействие тетрафторэтилена со спиртами и аминами с образованием эфиров и замещенных аминов соответственно:
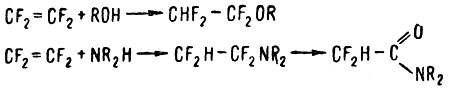
Уже в этих реакциях наблюдается своеобразие реакционной способности фторолефинов. Во-первых, этилен в тех же условиях со спиртами и аминами не реагирует. Тетрафторэтилен и другие фторолефины образуют со спиртами не только насыщенные эфиры RCFH - CF2OR, но и ненасыщенные соединения типа RCF = CF - OR. Последние образуются непосредственным замещением фтора во фторолефине.
Продукты присоединения аминов к фторолефинам - перфторалкиламины - легко гидролизуются в N-замещенные амиды фторкарбоновых кислот. При взаимодействии тетрафторэтилена с аммиаком образуется дифторацетонитрил, который самопроизвольно полимеризуется в три(дифтормстил)триазин.
При взаимодействии фторолефинов с гидроксиламином образуются фторангидриды фторированных гидроксамовых кислот. Все эти реакции не свойственны обычным олефинам. Они служат примером взаимодействия фторолефинов с электродонорными соединениями (нуклеофильными реагентами). Вместе с тем по мере исследований свойств фторолефинов было показано, что они в ряде случаев взаимодействуют с электрофильными реагентами. В одних случаях эти реакции протекают как радикальные и требуют тепла или каталитических добавок (например, реакция с двуокисью азота), а в других случаях (с сильно электрофильными веществами, например, серным ангидридом) они являются ионными и идут при обычной температуре.
Электрофильные соединения реагируют с фторолефинами в целом значительно труднее, нежели с их углеводородными аналогами. Однако простейшие фторолефины присоединяют галогены (Cl Вr и I) и смешанные галогены (ICl, BrCl и др.) при освещении или при нагревании сравнительно легко. Тетрафторэтилен с тетраокисью азота взаимодействует взрывообразно. Таким образом, в химическом поведении фторолефинов наблюдается электронная амфотерность, выраженная в способности участвовать в реакциях с нуклеофильными и электрофильными реагентами.
Это качество открывает широкие возможности для вовлечения фторолефинов в реакции, осуществляемые по различным механизмам и приводящим к огромному разнообразию веществ, в процессах получения и превращения которых проявляются специфические свойства фтора. Поясним это примерами.
Перфторизобутилен, присоединяя воду, превращается в моногидроперфторизомасляную кислоту (через стадию образования неустойчивого спирта):
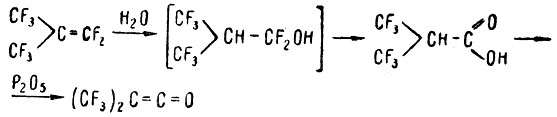
При отторжении элементов воды кислота превращается в бис (перфторметил)кетен, чрезвычайно реакционноспособное соединение, склонное к многочисленным реакциям обычных кетенов, а также обладающее рядом особенных химических свойств. Среди продуктов, получаемых из этих соединений, интересен оксим гектафторацетона - новый великолепный растворитель для полимеров. Другой пример. При взаимодействии тетрафторэтилена с тетраокисыо азота с высоким выходом получается нитронерфторэтилнитрит. Обычные нитриты при гидролизе превращаются а спирты - этот превращается в иитродифторуксусную кислоту, которая при обработке щелочью дает нитродифторметан, а при действии соляной кислотой - в нитрозодифторхлормеган:
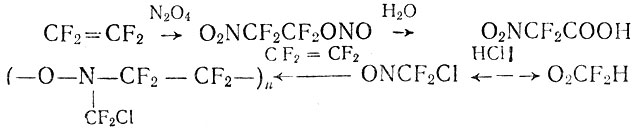
Хотя в приведенных реакциях фигурирует лишь ничтожная доля возможных превращений, для органика, привыкшего к химии углеводородов, они служат примером необычной химии.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'