
Пространственное строение и виды изомерии молекул
Учение о пространственном строении молекул прошло в своем развитии, как говорилось выше, несколько этапов. Бутлеровские формулы строения, хотя и на плоскости, уже отражают порядок относительного расположения атомов в цепи химического действия в молекуле, т. е. последовательность (и кратность) химических связей между атомами. На этом этапе стало возможным объяснить явление так называемой структурной изомерии, когда брутто формулы каких-то соединений одинаковы, а структурные формулы различны. Примером являются хотя бы указанные в нашем введении этиловый спирт и диметиловый эфир (см. стр. 9). Структурные изомеры образуют, как правило, совершенно различные вещества с особыми, характерными для них свойствами. Известны, однако, многие случаи динамической структурной изомерии или так называемой таутомерии, когда в обычных условиях легко рвутся одни и возникают другие связи атомов в молекуле, т. е. в равновесии сосуществуют, легко переходя друг в друга, молекулы, имеющие различные структурные формулы. В качестве примера можно привести кетоенольную таутомерию ацетилацетона:
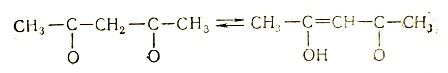
После введения бутлеровских формул строения в химии прочно укоренился и широко используется до настоящего времени термин "структура". Это слово, к сожалению, почти на всех языках эквивалентно русскому слову "строение", в которое должен вкладываться более глубокий смысл. Если химик-органик говорит "структура", а часто даже и строение, то он обычно имеет в виду только бутлеровскую структурную формулу соединения, о пространственном же строении молекулы, т. е. об относительном расположении связанных и несвязанных атомов в трехмерном пространстве, речи при этом не идет.
Вант-Гофф и Лебель в 1874 году впервые ввели представление о тетраэдрической направленности валентных связей атома углерода в молекулах (рис. 3, а), что явилось началом развития стереохимии. В настоящее время мы знаем, что атомы всех химических элементов существуют в молекулах в различных валентных состояниях, характеризуемых определенным числом (валентностью) и пространственной направленностью образуемых ими химических связей. Так, например, атом четырехвалентного углерода может иметь в молекулах, кроме упомянутого выше состояния с тетраэдрической системой связей, также валентные состояния с плоской (рис. 3, б) и линейной (рис. 3, в) системами химических связей.
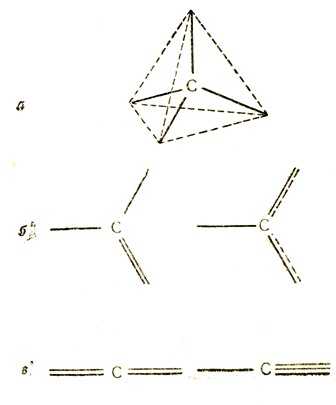
Рис.3. Валентные состояния четырехвалентного атома углерода в молекулах: а - в предельных соединениях (связи направлены от центра к вершинам правильного или слегка искаженного тетраэдра), б - в непредельных соединениях и ароматических соединениях (все связи лежат в одной плоскости, и все валентные углы равны или приблизительно равны), в - в соединениях с кумулированными двойными связями и с тройными связями (линейная система, угол, образуемый связями, равен 180°)
Назовем структурный элемент молекулы, образуемый каким-то центральным поливалентным атомом со своими (не менее чем двумя) заместителями, узлом. Валентные углы в узле, т. е. углы между прямыми, соединяющими химически связанные атомы, качественно определяются уже валентным состоянием центрального атома узла. Если, кроме того, известен порядок расположения атомов-заместителей и межатомные расстояния, т. е. расстояния по прямым, соединяющим центры (ядра) химически связанных атомов, то геометрия узла полностью определена.
В некоторых случаях, например, когда у атома углерода с тетраэдрической системой связей все четыре заместителя различны, вследствие асимметрии, возможны оптические* стереоизомеры:
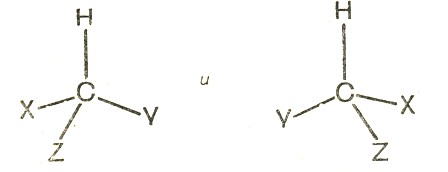
* (Оптическими эти изомеры названы потому, что соответствующие вещества имеют различное оптическое вращение, т. е. в противоположном направлении вращают плоскость поляризации проходящего через них света. Можно заметить, что указанные изомеры являются зеркальными антиподами и несовместимы друг с другом в пространстве.)
При рассмотрении этого вида пространственной изомерии, особенно когда дело касается молекул с несколькими асимметрическими центрами (узлами) в цепи или цикле, химики-органики употребляют термин "конфигурация". Этот термин имеет в данном случае только тот узкий смысл, что при одной и той же бутлеровской формуле строения определяет порядок расположения заместителей в асимметрических узлах молекулы. Различные "конфигурации" могут образоваться только при разрыве некоторых химических связей и перестановке местами заместителей в узле. Как и структурная изомерия, рассмотренная выше, конфигурационная изомерия может быть статической, т. е. различные "конфигурации" молекул данного соединения могут образовать различные по некоторым свойствам вещества, или динамической, когда различные "конфигурации" легко переходят друг в друга, находятся в равновесии и образуют одно вещество.
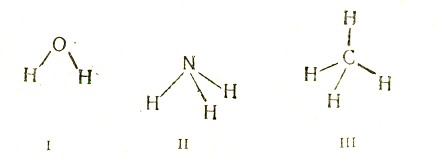
Такие простые молекулы, как молекула воды, I, аммиака, II, метана III, и т. п., представляют один узел. Более сложные молекулы состоят из ряда узлов, причем их центральные атомы, соединяясь между собой, образуют цепи или циклы. Назовем структурный элемент молекулы, образованный двумя соседними узлами, звеном. Для определения геометрии равновесной ядерной конфигурации сложной молекулы недостаточно знать лишь геометрические параметры узлов, т. е. валентные углы и межатомные расстояния. Возникает еще вопрос о том, как ориентированы друг относительно друга узлы в каждом звене, а в случае многих звеньев также - как ориентированы звенья в пространстве относительно друг друга.
Известно, например, что в молекуле этилена (С2Н4), представляющей одно звено, два плоских узла ориентированы друг относительно друга так, что вся молекула также является плоской. Если заместить один из атомов водорода в каждой группе =СН2 каким-либо другим, например атомом хлора, то можно получить два изомера одного и того же состава, но. различного строения:
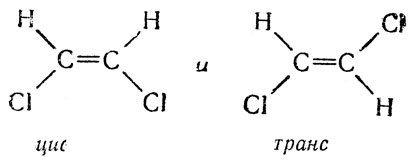
Молекулы этих изомеров образуют различные индивидуальные вещества, так как и сами имеют различные свойства, обладая прежде всего различной симметрией (точечные группы C2v и С2h соответственно). 3 обычных условиях они не могут переходить одна в другую, так как для поворота одной группы атомов =СНС1 относительно другой на 180° при вращении вокруг двойной связи требуется затрата такого же большого количества энергии, как и для разрыва химической связи (порядка 50 ккал/моль). Поэтому такие молекулы этиленовых и некоторых других непредельных соединений называют жесткими. По аналогии можно сказать, что рассмотренная цис-транс-изомерия непредельных соединений также дает различные "конфигурации" молекул в только что указанном выше смысле, придаваемом этому термину в химии.
Но вопрос о взаимной ориентации узлов возникает не только в случае непредельных соединений, а в любом случае, когда речь идет о двух связанных нелинейных узлах. Действительно, если взять, например, простейшую в этом смысле молекулу перекиси водорода (Н2О2), представляющую одно звено и образованную нелинейными узлами, то оказывается, что она не является плоской, а в проекции на плоскость, перпендикулярную связи О-О, связи О-Н образуют примерно прямой угол, а не угол, равный 0 или 180° (точечная группа симметрии С2):
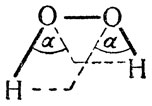
Вопрос при этом заключается также в том, насколько жесткой будет молекула при определенной взаимной ориентации Двух узлов, когда они соединены не двойной и вообще не кратной, как в непредельных соединениях, а простой химической связью. Возможно ли в молекулах предельных соединений лишь некоторое крутильное колебание связанных узлoв относительно положения равновесия или узлы могут поворачиваться, друг относительно друга на большие углы - вплоть до полного вращения на 360° к исходному устойчивому положению? Если такое вращение, называемое внутренним вращением 'молекул, возможно, то насколько оно свободно или заторможено?
Более или менее подробному рассмотрению этих вопросов посвящены последующие разделы книги, но предварительный ответ на них, для целостности изложения, соответствующего названию данной главы, следует дать сразу.
В классической стереохимии предполагалась возможность совершенно свободного вращения групп атомов вокруг ординарных связей, т. е. возможность любой взаимной ориентации узлов молекулы друг относительно друга в пространстве. Позднее, а именно в самом начале 30-х годов нашего века, было доказано, что это не так. Теперь известно, что внутреннее вращение молекул, хотя и возможно по крайней мере не в очень сложных молекулах, в большинстве случаев, если речь идет не о линейных системах связанных атомов, не свободно, а заторможено. Это значит, что существуют вполне определенные преимущественные по своей устойчивости равновесные ядерные конфигурации молекул с определенной взаимной ориентацией узлов в пространстве, которые могут переходить друг в друга. Для таких устойчивых равновесных ядерных конфигураций молекул в органической химии был принят несколько лет тому назад термин "конформация". Это можно рассматривать, как третий этап развития пространственных представлений в химии.
Целесообразно, по-видимому, еще раз остановиться на химической терминологии, соответствующей трем представлениям молекулы, сохранившимся в химии как наследие трех стадий развития стереохимии. Итак, термин "структура" или "строение" (в узком смысле) определяет порядок, химических связей атомов в молекуле и отвечает бутлеровской формуле строения. Термин "конфигурация" (тоже в узком смысле) подразумевает определенную "структуру", но, кроме того, определяет порядок расположения заместителей у асимметрических центров, или такие формы молекул одной и той же "структуры", которые не могут переходить друг в друга без разрыва химических связей и перестановки заместителей местами в узле при каком-то данном центральном атоме. И наконец, термин "конформация" предполагает знание "структуры" и "конфигурации" молекулы (я указанном смысле этих терминов), но, кроме того, определяет ориентацию узлов молекулы в пространстве друг относительно друга. Таким образом, последний термин является наиболее широким, так как включает в себя представление о молекуле, даваемое двумя предыдущими терминами.
Следует подчеркнуть, что определенное нами ранее физическое понятие равновесной ядерной конфигурации, которым мы будем пользоваться и в дальнейшем, содержит всю информацию о пространственной геометрии молекулы (точнее, ее ядерного скелета), включая значения всех межатомных расстояний, валентных и двугранных углов, т. е. предусматривает и знание всего, что определяется химическими терминами "структура", "конфигурация" и "конформация". Хотя это понятие является более общим как и обычное слово конфигурация в понимании пространственной геометрической формы любого предмета, тем не менее в химии, особенно в органической, параллельно продолжают использоваться и все перечисленные специфические термины, которые мы берем в кавычки, опуская их ниже только для термина конформация. Это обосновано, по-видимому, тем, что каждая из особенностей химического строения молекул данного вещества, отражаемая одним из трех представлений: "структура", "конфигурация" и конформация, ответственна за какую-то группу свойств вещества. При этом главную роль, определяющую ряд важнейших свойств вещества, играет порядок химических связей атомов в молекуле, отражаемый бутлеровской. формулой строения - "структурой". Однако некоторые специфические свойства, отдельных веществ, благодаря которым эти вещества представляют большую ценность или даже незаменимы для человека, часто целиком зависят от "конфигурации" или конформации их молекул, с. чем мы еще встретимся в последней главе этой книжки.
С указанными тремя терминами связаны три главных вида изомерии молекул. В самом общем определении изомерными называются молекулы одинакового химического состава, но различного химического строения, если понимать последнее в самом широком смысле. В соответствии со сказанным выше три главных вида изомерии суть: структурная изомерия, конфигурационная изомерия и конформационная изомерия. Независимо оттого, будет ли каждый из этих видов в каких-то конкретных случаях характеризовать статическую или динамическую изомерию, их можно определить следующим образом. Структурная изомерия связана с изменением порядка химических связей атомов в молекуле, т. е. с обменом местами заместителей в различных узлах молекулы, что можно отразить бутлеровскими формулами строения. Конфигурационная изомерия связана с изменением порядка расположения, т. е. с переменой местами заместителей в одном или нескольких узлах молекулы, но не между различными узлами, что можно отразить так называемыми формулами Фишера на плоскости. Переход от пространственной модели какой-то "конфигурации" с двумя асимметрическими центрами (узлами) к ее изображению в виде формулы Фишера на плоскости иллюстрируется, например, рисунком 4. И наконец, конформационная изомерия связана с поворотом (поэтому ее называют также поворотной или вращательной изомерией), узлов молекулы друг относительно друга в пространстве без изменения порядка химических связей и расположения атомов в узлах. Этот вид изомерии полностью можно отразить только пространственными моделями молекул или формулами Ньюмена, представление которых на плоскости не всегда, легко осуществимо для сложных соединений.
Рис.4. Схема перехода от постоянной модели молекулы с двумя асимметрическими центами к ее изображению на плоскости в виде формул Фишера
Все три вида изомерии в соответствии с широтой терминов описывают какие-то стороны пространственной изомерии молекул. При этом каждый структурный изомер может иметь несколько конфигурационных изомеров, а каждый из, последних - несколько конформационных изомеров (конформеров). Иными словами, когда химики говорят о данной "структуре", то отвлекаются от возможности различных "конфигураций" и конформаций; когда говорят о данной "конфигурации", то имеют в виду определенную "структуру", но отвлекаются от возможности различных конформаций; когда говорят о данной конформаций, то имеют в виду и определенную "структуру", и определенную "конфигурацию". Таким образом, изучение внутреннего вращения и устойчивых конформаций молекул преследует цель наиболее полного описания их пространственного строения и установления связи тонких деталей химического строения молекул со свойствами вещества.
Хотя мы и так уже немало времени посвятили вопросам терминологии, и читатель, возможно, утомлен ею, однако нельзя не отметить еще одного специального термина. В химии часто употребляется слово "стереоизомерия", которое эквивалентно понятию пространственной изомерии, но обычно используется химиками только в том смысле, как мы определили здесь конфигурационную изомерию.
Сложность вопросов строения молекул вызвала и сложность химической терминологии.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'