
Вращательная изомерия
Рассмотрим более подробно связанное с заторможенным внутренним вращением явление конформационной изомерии, которую называют также вращательной или поворотной изомерией молекул. В случае молекулы этана, как мы видели, все три устойчивые "шахматные" ядерные конфигурации, образующиеся при постепенном повороте одной метальной группы относительно другой на 360°, совершенно идентичны друг другу по всем свойствам, т. е. можно говорить лишь об одной реально существующей конформаций молекул этана ("затененные" формы неустойчивы, и никакой второй конформаций у этана нет). Аналогичным образом дело обстоит у молекул ацетальдёгида, пропилена и всех других молекул, когда хотя бы в одном тетраэдрическом узле какого-то звена все три заместителя одинаковы. В этом, т. е. в равноценности относительных положений взаимодействующих, но "не связанных друг с другом атомов вращающихся групп, легко убедиться, если смотреть на проекции устойчивых форм монозамещенных, 1, 1-дизамещенных этана и других этаноподобных молекул общего вида:
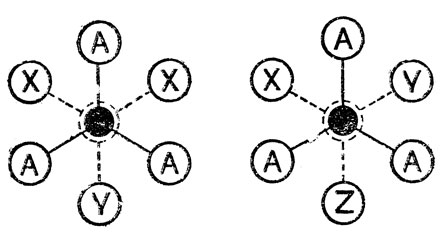
Во всех этих случаях заторможенное внутреннее вращение приводит к неотличимым по всем свойствам устойчивым формам молекул, т. е. конформаоционной изомерии не возникает.
Возьмем теперь в качестве примера молекулу 1, 2-дизамещенного этана (1, 2 -дихлорэтан, СН2Сl-СН2Сl, или нормальный бутан СН3СН2-СН2СН3 т. п.), т. е. случай, когда. в каждом из двух тетраэдрических узлов звена есть разные заместители- по одному заместителю, скажем X, и по два атома водорода. Как и у других молекул предельных соединений, устойчивыми ядерными конфигурациями молекул такого соединения оказываются "шахматные". Но будут ли они все в этом случае тождественны друг другу? Как можно видеть на рис. 7, где показаны пространственные модели и проекции "шахматных" ядерных конфигураций молекулы 1,2-дизамещенного этана, они не все одинаковы. Действительно, одна ядерная конфигурация, названная транс-формой, характеризуется максимальным удалением заместителей X друг относительно друга и относится к точечной группе симметрии С2h, а в двух следующих, называемых скошенными или гош-формами. (укоренившийся французский термин), являющихся зеркальными антиподами и относящихся к точечной группе симметрии С2, заместители X сближены. Таким образом, -мы сталкиваемся здесь с определенного вида пространственной изомерией молекул.
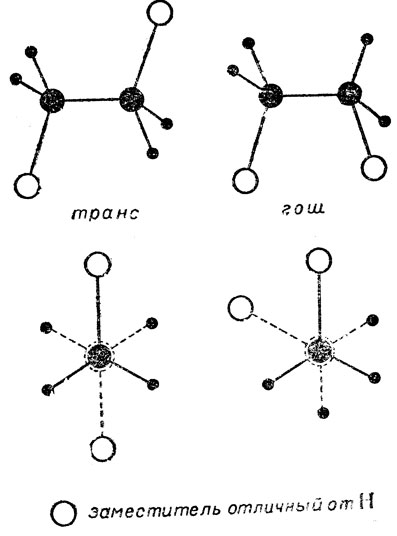
Рис.7. Пространственные модели и 'шахматные' проекции ядерных скелетов устойчивых конформаций молекул 1,2 - дизамещенных этанов
Реальное существование в веществах указанных различных форм молекул, т. е. поворотных изомеров или конформеров, устанавливается рядом физических и физико-химических методов. Метод электронной дифракции, например, позволяет достаточно точно измерять межъядерные расстояния не только для химически связанных атомов, но и для непосредственно не связанных атомов и в случае, скажем, 1, 2-дихлорэтана дает два значения межатомного расстояния Сl,.. Сl, т. е. указывает на существование двух форм молекул. Поскольку расстояние О ... Сl зависит от угла поворота групп -СН2Сl друг относительно друга, то при известных значениях меж-атомных расстояний С-Сl и С-С и валентных углов ∠CCC1 но измеренным расстояниям Сl,,. Сl легко вычисляются значения указанного угла поворота групп -СН2Сl для устойчивых транс- и гош-конформаций молекулы. Геометрия поворотных изомеров может быть определена и другими методами исследования равновесных ядерных конфигураций молекул, например методами спектроскопии (микроволновой и в далекой инфракрасной области, комбинационного рассеяния света при высоком разрешении). Действительно, можно понять, что моменты инерции у транс- и гош-изомеров при вращении вокруг трех взаимно перпендикулярных главных осей, пересекающихся в центре тяжести, будут различны, поскольку они связаны с относительным расположением в пространстве масс атомов. Поэтому поворотные изомеры будут иметь различные наборы вращательных энергетических уровней (связанных с моментами инерции) и различные вращательные спектры, исследуя которые можно получить информацию о геометрии изомерных форм.
Отличие поворотных изомеров не является просто формальным или только геометрическим: разница в пространственном строении равновесных ядерных конфигураций и их симметрии вносит существенные различия и в другие свойства молекул. Мы только что говорили о разнице в наборах возможных вращательных уровней энергии изомерных форм, но различаются у них и другие составляющие энергии! Прежде всего следует иметь в виду различие целого ряда колебательных уровней энергии поворотных изомеров, так как механика колебаний включает зависимость энергий и частот от относительного расположения колеблющихся масс в пространстве. В результате внутреннего вращения поворотные, изомеры в газообразном и жидком состояниях веществ находятся в динамическом равновесии, т. е. быстро переходят друг в друга. Однако время жизни каждой устойчивой конформации (порядка 10-10сек) оказывается достаточно велико, для того чтобы молекула успела сотни и даже тысячи раз изменить за это время свои колебательные состояния. Иными словами, частоты переходов между колебательными уровнями - энергии (порядка 1012-1014сек-1) значительно больше частот перехода одной поворотно-изомерной формы молекулы в другую (порядка 1010сек-1). Поэтому методы инфракрасной спектроскопии и спектроскопии комбинационного рассеяния позволяют получать и исследовать суммарные спектры всех реализующихся поворотных изомеров. Эти спектры дают информацию не только о геометрии конформаций, упругих силах, действующих в молекуле между атомами, и колебательных энергетических уровнях. Исследуя температурную зависимость интенсивностей полос в колебательных спектрах, которые пропорциональны концентрациям определенных форм - молекул, можно также изучать конформационные равновесия, т. е. характер заторможенного внутреннего вращения молекул, обладающих поворотной изомерией.
В случае 1, 2-дихлорэтана, например, колебание, связанное в основном с изменением межатомных расстояний С-О (так называемое валентное колебание С-О), в силу различного относительного расположения в пространстве атомов хлора имеет у транс - и гош-изомеров различную частоту. Наблюдаемые в спектре полосы ИК-поглощения или комбинационного рассеяния света таких колебаний и могут использоваться для изучения конформационного равновесия по температурной зависимости их относительной интенсивности, т. е. для определения относительной устойчивости поворотных изомеров и их концентраций в смеси. Обозначим наблюдаемые интенсивности выбранных полос гош- и транс-изомероз в спектре через Iг и Iт, соответственно, мольные интенсивности этих полос как аг и ат, а мольные доли изомеров - как Nr и Nт (Nг+Nт=l); тогда Iг = aгNг, а Iт=aтNт. Константа равновесия, определяемая как отношение мольных долей изомеров, равна: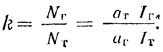
Если принять отношение мольных интенсивностей - aт/aг постоянным (независимым от температуры), то отношение наблюдаемых интенсивностей Iг/Iт с точностью до постоянного множителя равно истинной константе равновесия поворотных изомеров. В химической термодинамике установлена следующая связь изменения константы равновесия (от абсолютной температуры Т1 до абсолютной температуры Т2) с энергетической разницей ΔЕ равновесных форм: 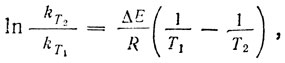 , где R - универсальная газовая постоянная.
, где R - универсальная газовая постоянная.
Таким образом, если экспериментально измерить отношение интенсивностей Iг/Iт при различных температурах, то можно найти разницу энергий поворотных изомеров и оценить их мольные доли. Эти величины определяются и другими физическими методами, о которых отчасти уже говорилось выше. Поворотные изомеры могут различаться по энергиям довольно существенно. Так, например, было найдено, что в парах 1, 2-дихлорэтана при температурах, близких к комнатной, разность энергий, ΔЕ, составляет приблизительно 1, 2 ккал/моль, причем менее устойчив гош-изомер, концентрация которого близка к 20% (Nг≅0,2). В случае н-бутана ΔЕ=0,8 ккал/моль, и также менее устойчив гош-изомер, но, например, у хлористого и бромистого пропилов (СН3СН2- -СН2С1 или Вr), этилхлорсилана (СН3СН2-SiH2Cl) и некоторых других молекул в газообразном и жидком состоянии вещества несколько менее устойчивым оказывается трансизомер. Если разность энергий поворотных изомеров приближается к 3 ккал/моль, то при обычных температурах это соответствует уже концентрациям менее устойчивой конформации порядка 1 % и менее.
У поворотных изомеров могут сильно различаться также электрические свойства, т. е. дипольный момент 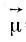 , и поляризуемость, α. Например, транс-конформация 1,2-дихлорэтана обладает достаточно высокой симметрией С2h (ось симметрии второго порядка, перпендикулярная ей плоскость и центр симметрии), так что "центры тяжести" положительных и отрицательных зарядов в ней совпадают, и молекула не имеет собственного дипольного момента (μ=0). Если бы все молекулы в 1,2-дихлорэтане имели транс-конформацию, то это было бы совершенно неполярное вещество. Однако гош-конформация молекулы этого соединения, имеющая только ось симметрии второго порядка, С2, обладает значительным собственным дипольным моментом. Поскольку оба поворотных изомера находятся в 1,2-дихлорэтана в смеси, то экспериментально измеряемый дипольный момент, во-первых, имеет некоторое промежуточное значение на граммоль смеси, а во-вторых, зависит от температуры, так как соотношение концентраций находящихся в равновесии и переходящих друг в друга конформаций, как мы уже говорили, при изменении температуры меняется. Таким образом, изучение температурной зависимости дипольного момента является еще одним методом исследования заторможенного внутреннего вращения молекул вещества и конформационного равновесия в нем. Этим методом тоже могут определяться разности энергий, ΔЕ, поворотных изомеров, отличающихся значениями собственных дипольных моментов. Ниже мы встретимся и с некоторыми другими методами изучения внутреннего вращения и поворотной изомерии молекул.
, и поляризуемость, α. Например, транс-конформация 1,2-дихлорэтана обладает достаточно высокой симметрией С2h (ось симметрии второго порядка, перпендикулярная ей плоскость и центр симметрии), так что "центры тяжести" положительных и отрицательных зарядов в ней совпадают, и молекула не имеет собственного дипольного момента (μ=0). Если бы все молекулы в 1,2-дихлорэтане имели транс-конформацию, то это было бы совершенно неполярное вещество. Однако гош-конформация молекулы этого соединения, имеющая только ось симметрии второго порядка, С2, обладает значительным собственным дипольным моментом. Поскольку оба поворотных изомера находятся в 1,2-дихлорэтана в смеси, то экспериментально измеряемый дипольный момент, во-первых, имеет некоторое промежуточное значение на граммоль смеси, а во-вторых, зависит от температуры, так как соотношение концентраций находящихся в равновесии и переходящих друг в друга конформаций, как мы уже говорили, при изменении температуры меняется. Таким образом, изучение температурной зависимости дипольного момента является еще одним методом исследования заторможенного внутреннего вращения молекул вещества и конформационного равновесия в нем. Этим методом тоже могут определяться разности энергий, ΔЕ, поворотных изомеров, отличающихся значениями собственных дипольных моментов. Ниже мы встретимся и с некоторыми другими методами изучения внутреннего вращения и поворотной изомерии молекул.
По причине сильного различия характера межмолекулярных взаимодействий в различных агрегатных состояниях веществ поворотные изомеры могут по-разному вести себя в зависимости от фазы вещества. О конформациях молекул в твердой фазе мы будем говорить отдельно в следующей главе, но и при переходе от газообразного состояния вещества к жидкому могут происходить существенные изменения в соотношении концентраций поворотных изомеров. Так, если поворотные изомеры сильно различаются дипольными моментами, то в жидком состоянии вещества энергия изомера, обладающего большим дипольным моментом, в результате ориентационного взаимодействия полярных молекул понижается значительно сильнее, чем энергия изомера с меньшим дипольным моментом, т. е. происходит стабилизация более полярных конформаций, концентрация их увеличивается. В случае 1,2-дихлорэтана разность энергий поворотных изомеров в жидком состоянии вещества из-за стабилизации полярной гош-конформации становится равной нулю вместо 1,2 ккал/моль в газообразном состоянии. С другой стороны, у н-бутана или галоидных пропилов, поворотные изомеры которых мало отличаются по своим дипольным моментам, существенного изменения разности их энергий и, соответственно, концентраций при переходе от газа к жидкости не наблюдается.
Из сказанного выше очевидно, что характер заторможенного внутреннего вращения в случае молекул, обладающих поворотной изомерией, сложнее, чем у молекул, не дающих этого эффекта. Действительно, например, у молекул типа 1,2-дизамещенных этана функция потенциальной энергии, как видно из рис. 8, где показаны качественные потенциальные кривые 1,2-дихлорэтана (газ), н-бутана и галоидных пропилов, включает не один параметр (V0), как у молекул этана или пропилена и т. п., а три: два потенциальных барьера, V1 и V2, и разность энергий поворотных изомеров, ΔЕ. В более сложных случаях, например в случае молекул 2-замещенный бутанов (СН3СНХ-СН2СН3), когда в одном узле все три заместителя различны (Н, X и СН3), а в другом имеется два вида заместителей (Н и СН3), или в случае, когда все заместители обоих узлов различны, на кривой потенциальной энергии внутреннего вращения молекулы, в отличие от показанной на рис. 8, будут разными все минимумы и все максимумы, т. е. число параметров потенциальной функции еще больше возрастает.
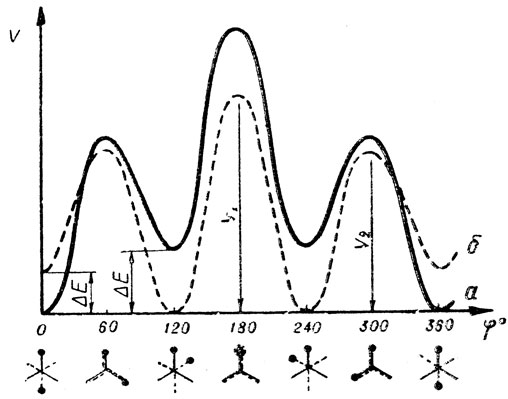
Рис.8. Качественные потенциальные кривые внутреннего вращения: а - н-бутан, 1,2-дигалоненэтанов; б - первичных галоидных пропилов
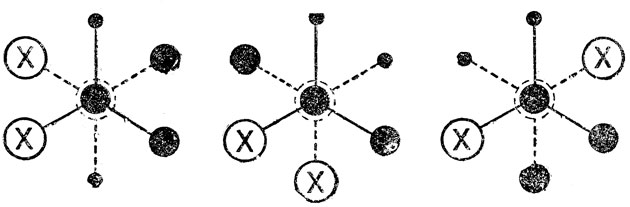
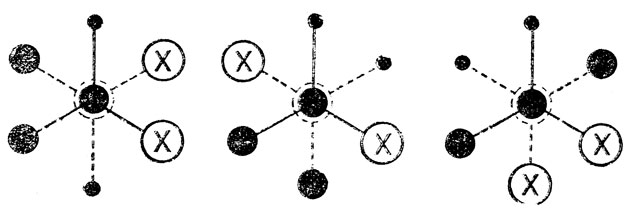
Действительно, у бутанов, замещенных в положении 2(Х=Сl, Вr и т. д.), появляются три различные устойчивые конформации, "шахматные" проекции которых имеют следующий вид:
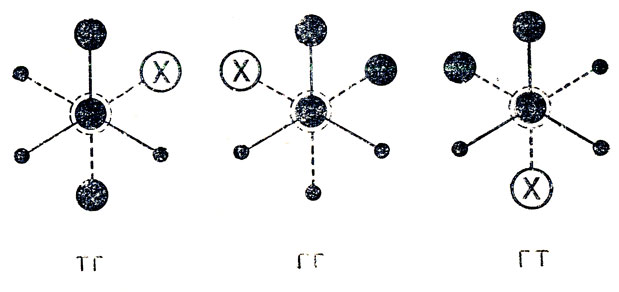
Эти конформации имеют свои энергии, т. е. можно говорить об их разностях; различны также все потенциальные барьеры. перехода одной конформации в другую. Следует отметить, что, у молекул 2-замещенных бутанов имеется один асимметрический центр (узел), т. е. возможны лево- и правовращающие оптические изомеры или "конфигурации", однако на числе и различиях конформации это не сказывается. Другое дело, если мы возьмем молекулу с двумя асимметрическими центрами (узлами), например 2, 3-дизамещенного бутана (СН3СНХ-СНХСН3), у которого возможны различные "конфигурации" не только узлов, но и звена молекулы. Как показано ниже, у одной, оптически неактивной формы (мезо-формы), из трех устойчивых "шахматных" конформации две являются идентичными по относительному расположению несвязанных атомов вращающихся групп, по энергиям, электрическим свойствам и т. д., т. е. можно говорить, как и в случае 1, 2-дизамещенных этанов, о существовании только двух по-воротных изомеров родного из них со статистическим весом 2):
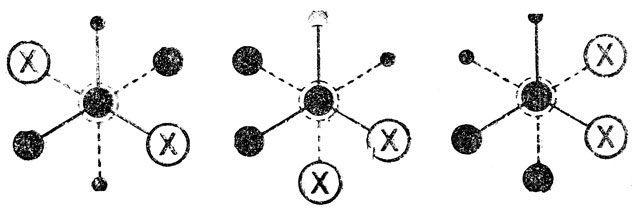
Потенциальная кривая- внутреннего вращения такой мезо-"конфигурации" также аналогична показанной на рис. 8 для молекул типа 1, 2-дизамещенных этанов.
В то же время у оптически активных "конфигураций" (два антипода) молекул 2,3-дизамещенного бутана все три конформации различны, т. е. реально существуют три поворотных изомера, и потенциальная кривая заторможенного внутреннего вращения будет аналогична кривой 2-замещенных бутанов. Можно заметить, что конформации двух оптических антиподов попарно одинаковы по относительному расположению несвязанных атомов, энергиям, электрическим свойствам и т. д.
Легко представить, что при переходе к молекулам с несколькими звеньями, внутреннее вращение в которых сопровождается появлением различных устойчивых конформации, вся картина этого явления сильно усложняется.
Рассмотрим еще один важный и хорошо изученный пример интересующего нас явления - случай предельных шестичленных циклических систем. Сюда относятся прежде всего соединения ряда циклогексана (C6H12), а также некоторые гетероциклы, когда в предельном шестичленном кольце один или несколько атомов углерода заменены другими атомами, например азота (пиперидин, С5H10NН) и т. д. В молекуле циклогексана шесть тетраэдрических узлов соединены между собой одинарными связями так, что они образуют не напряженную замкнутую циклическую систему. В случае пиперидина различие состоит лишь в том, что один из тетраэдрических узлов заменен пирамидальным - с атомом азота в качестве центрального атома в узле. При сохранении валентных углов в узлах, близких к тетраэдрическим (приблизительно 109-110°), шестичленные циклы могут иметь форму либо "ванны":
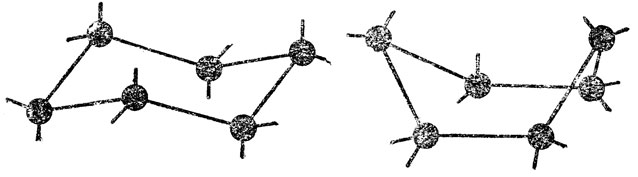
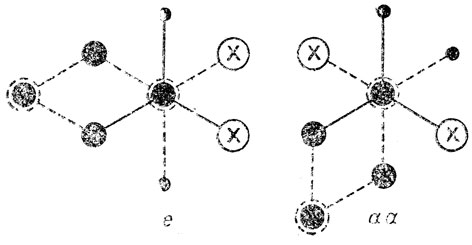
Экспериментально было, однако, показано что, если форма "ванны" реально и существует, то очень мало устойчива, т.е. концентрация ее ничтожна, и при обычных условиях ею практически можно пренебречь. Устойчивая форма "кресла" имеет тy интересную особенность, что внециклические связи (С-Н) в ней ориентированы по отношению псевдоплоскости* цикла двояким образом: шесть таких связей перпендикулярны к ней параллельны друг другу и вертикальной зеркально-поворогной оси симметрии шестого порядка, S6, а шесть других таких связей примерно лежат в указанной псевдоплоскости (точнее, образуют с ней одинаковые острые углы). Первые шесть связей называются аксиальными (они помечены ниже на чертеже буквой а) или полярными, а вторые - экваториальными (обозначены на том же чертеже буквой е).
* (Плоскость, секущая цикл через середины всех связей С-С.)
Полное внутреннее вращение вокруг одинарных связей на 360° в цикле без его разрыва невозможно, но частичное одновременное кручение узлов друг относительно друга с преодолением некоторого потенциального барьера может происходить. В результате этого при обычных условиях в газообразном и жидком состояниях циклогексана или пиперидина и аналогичных систем возможна так называемая конверсия креслообразной формы когда аксиальные связи становятся экваториальными, и наоборот.
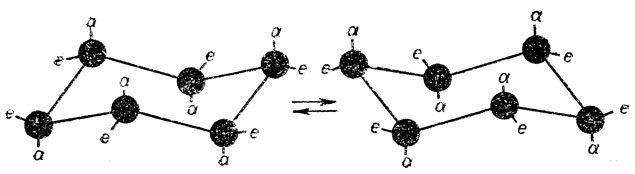
Две равновесные ядерные конфигурации молекулы, получающиеся в результате конверсии креслообразной формы циклогексана, ничем неотличимы друг от друга, т. е. можно говорить об одной конформации "кресла". По-другому обстоит дело в случае замещенных циклогексана, а также самого пиперидина и его замещенных. Действительно, если происходит конверсия монозамещенного циклогексана или пиперидина по схеме, то возникает конформационная изомерия, так как заместитель (у пиперидина атом водорода при азоте) может занимать либо экваториальное, либо аксиальное положение.
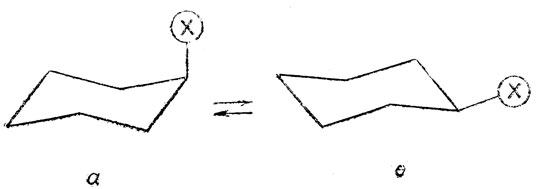
Получающиеся при этом конформации так и называют: экваториальной, е или аксиальной, а. Эти конформацим, как и поворотные изомеры соединений с открытой цепью, рассмотренные выше, отличаются по своим свойствам. Имеются, например, следующие экспериментальные данные о разностях энергий конформеров некоторых производных диклогексана и пиперидина:
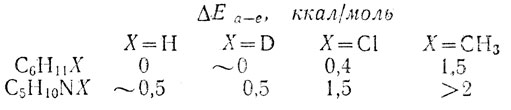
Интересна возможность проведения известной аналогий между конформациями монозамещенного диклогексана и определенными поворотными изомерами 2-замещенных бутана. Сравним проекции узлов аксиальной и экваториальной конформаций монозамещенного диклогексана на плоскость, перпендикулярную любой из двух связей С-С с участием атома: углерода, имеющим заместитель Х, с проекциями поворотных изомеров 2-замещеннчзго бутана, показанными на стр. 38. Легко видеть, что аксиальная конформации аналогична ГГ-поворотному изомеру, а экваториальная конформадия - ГТ-поворотному изомеру. В монозамещенном циклогексане имеется два звена молекулы вида ССНХ-СН2С, и у аксиальной конформации оба они имеют ГГ-поворотно-изомерную форму, а у экваториальной конфорнации оба имеют ГТ-поворотно-изомерную форму. На основании этого можно предполагать, что разность энергий аксиальной и экваториальной конформации монозамещенного диклогексана, ΔЕа-е, должна быть в два раза больше разности энергий ГГ- и ГТ-поворотных изомеров, ΔЕгг-гт, соответствующего 2-замещенного бутана, у которого имеется лишь одно звено вида CCНХ-СН2С. Это предположение подтверждается, например, в случае хлорциклогексана и 2-хлорбутана, для которых выполняется соотношение разностей энергий: ΔЕа-е(С6Н11Сl)=0,4ккал/моль=2×ΔЕгг-гт(2-С4Н9Сl) = 2×0,2 ккал/моль, и было подтверждено экспериментально также для некоторых других случаев. Такие сопоставления и оценки относительной устойчивости конформации сложных молекул весьма полезны и с успехом используются в широко вошедшем в практику органической химии конформационном анализе.
При наличии двух заместителей у разных атомов шестичленного цикла в результате появления двух асимметрических центров (узлов) возникает стереоизомерия, которую мы определяем как конфигурационную. Заместители могут быть расположены по одну сторону от псевдоплоскости цикла, так называемая - цис-"конфигурация", или по разные стороны этой плоскости - транс-"конфигурация". В каждом из этих случаев возможна конверсия "кресла", но при одинаковых заместителях только у некоторых "конфигураций" в результате этой конверсии возникает конформационная изомерия:
транс - 1,2 - замещенные
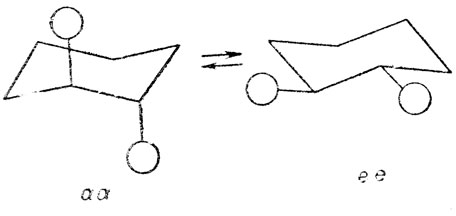
цис -1,3 - замещенные
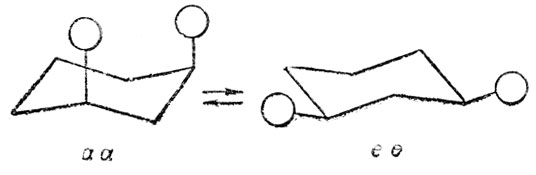
транс - 1,4 - замещенные
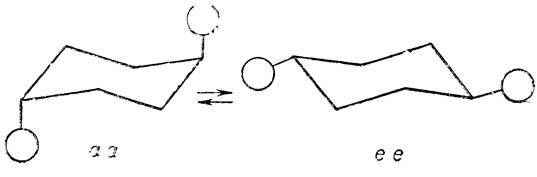
"Шахматные" проекции ее и аа конформацда транс- 1,2-дизамещенного циклогексаиа на плоскость, перпендикулярную связи между атомами углерода, при которых находятся заместители; сходны с проекциями соответствующих поворотных изомеров оптически активной формы 2,3-дизамещенного бутана (см, стр. 39).
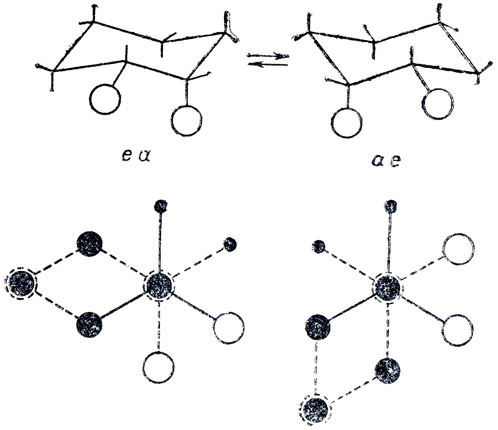
У цис-1, 2-, транс-1,3 цис-1,4-дизамещенных циклогексанов один заместитель занимает аксиальное, а другой - экваториальное положения, и при конверсии цикла в форме "кресла" получаются конформации еа и ае, т. е. при одинаковых заместителях конформационной изомерии "нет. Заметим, что одинаковые при одинаковых заместителях конформации ае и еацис-1,2-дизамещенных циклогексана в известном смысле аналогичны одинаковым конформациям мезо-"конфигурации" 2, 3-дизамещенных бутана, так как аналогичны их "шахматные" проекции (см. стр. 40, 45).
При увеличении числа заместителей картина, естественно, усложняется, так как число различных возможных "конфигураций" и конфирмации возрастает.
Хотя потенциальный барьер внутреннего кручения или конверсии шестичленного цикла сравнительно велик (10-15 ккал/моль), он еще может легко преодолеваться при обычных температурах. Как в случае таких циклических систем, так и в случае довольно сложных соединений с открытой цепью можно безапелляционно утверждать, что в газообразном и жидком состояниях веществ заторможенное внутреннее вращение (или кручение) молекул имеет место. В результате этого поворотные изомеры или конформеры молекул, если они реально существуют, т. е. достаточно устойчивы (есть соответствующие им "несмазанные" минимумы потенциальной энергии внутреннего вращения), находятся в динамическом равновесии, а химическое вещество представляет при этом равновесную смесь различных конформации молекул и все его свойства суть свойства такой смеси. Переход поворотных изомеров (конформеров) друг в друга осуществляется настолько быстро, что разделить их в жидкостях и газах не представляется возможным. По этой же причине невозможно изучать конформационные равновесия химическими методами. Мы видели выше, что для идентификации конформаций молекул, имеющих степень свободы внутреннего вращения, и исследования конформационных равновесий применяются исключительно физические методы, да и среди них не все могут оказаться достаточно эффективными. Так, например, метод ядерного магнитного резонанса (ЯМР), очень чувствительный к изменению ближайшего окружения какого-либо ядра, обладающего спиновым магнитным моментом, не обнаруживает при обычных температурах разницы между аксиальными и экваториальными атомами водорода (протонами) в циклогексане. Это связано с тем, что частота перехода между различными спиновыми состояниями (энергетическими уровнями) протонов меньше, чем частота конверсии цикла, и метод позволяет фиксировать лишь какое-то усредненное для двух возможных положений протонов значение резонансной частоты (или напряженности магнитного поля). Только при понижении температуры до -67°С конверсия циклогексана настолько замедляется, что в спектре ЯМР четко наблюдаются два отдельных пика поглощения электромагнитного излучения в радиочастотной области, соответствующих энергетическим переходам аксиальных и экваториальных, протонов, В некоторых случаях, особенно при пониженных температурах, метод ЯМР может успешно использоваться для исследования конформационных равновесий и определения потенциальных барьеров внутреннего вращения, наряду с методами оптической и микроволновой спектроскопии.
В этой главе мы рассмотрели явление конформационной или вращательной изомерии молекул на примере лишь нескольких соединений, относящихся в основном к углеводородам и их производным. Надо, однако, помнить, что это явление в газовой и жидкой фазах веществ, образуемых молекулами органических, а также некоторых неорганических и комплексных соединений, имеет весьма общий характер. Поэтому для правильного понимания свойств веществ и их связи со строением молекул необходимо всегда рассматривать вопрос о пространственном строении молекул с учетом возможности появления различных устойчивых конформаций и равновесия между ними. Несколько особняком стоит твердая фаза вещества*, в которой обычно динамического равновесия между различными конформациями нет, но характер которой также зависит от конформационного состава соединения.
* (Мы говорим о твердой фазе без различия того, идет ли речь о веществах, являющихся твердыми при обычных температурах, или о жидких и газообразных веществах, твердая, фаза которых может быть получена при низких температурах.)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'