
Глава 14. Электронная структура молекул с дефицитом электронов
14.1. Структура диборана
Когда химик называет связь в молекуле ковалентной, он обычно подразумевает несколько свойств. Например, летучесть соединения слабо связана с его молекулярным весом, атомы в молекуле удерживаются друг возле друга в более или менее фиксированном положении валентными силами, обладающими высокой направленностью; каждой паре связанных атомов соответствуют по крайней мере два образующих связь электрона (но может быть и больше). Существует ряд молекул, которые, согласно этим критериям, являются ковалентными, с тем исключением, что для них не выполняется требование наличия по крайней мере двух электронов, сопоставляемых каждой паре связанных атомов. Наиболее известный пример - молекула диборана В2Н6, в которой должно быть по меньшей мере семь связей и, следовательно, четырнадцать электронов для образования этих связей. На самом деле имеются лишь двенадцать валентных электронов. Соединения такого типа называют соединениями с электронным дефицитом. Этот термин употребляют по отношению ко всем молекулам, у которых число валентных электронов меньше чем 2 (n - 1), где n - число атомов *).
*) (Для того чтобы удержать вместе n атомов, требуется по крайней мере n - 1 связей и, следовательно, в обычной схеме электронных пар - 2 (n - 1) валентных электронов.)
Все известные в настоящее время бороводороды относятся к соединениям с электронным дефицитом, так же как и большинство образующихся из них анионов. Хотя большая часть настоящей главы будет посвящена обсуждению таких молекул с электронным дефицитом, которые содержат атомы бора, большинство элементов третьей и некоторые из элементов второй групп периодической системы также образуют соединения с электронным дефицитом. При менее строгом определении понятия электронного дефицита требуется лишь, чтобы в молекуле было меньше чем 2m валентных электронов, где m - число формальных связей. В эту категорию попадают все соединения, в которых ненасыщенные органические молекулы связаны с переходным металлом (например, ферроцены). Они обсуждаются в последней главе этой книги.
Эксперименты показывают, что в молекуле диборана четыре (концевых) атома водорода и атомы бора лежат в одной плоскости, а два (мостиковых) атома водорода расположены симметрично над этой плоскостью и под ней, как показано на рис. 14,1 *). Молекула принадлежит к группе симметрии D2h, характеры НП которой приведены в табл. 14.1. В такой структуре, очевидно, должно быть восемь двухэлектронных связей, т. е. шестнадцать валентных электронов. Существует несколько различных теорий, объясняющих связь в этой молекуле [52]. Здесь дается описание по методу МО, считающееся наиболее удовлетворительным.
*) (В работе [52] собраны данные, подтверждающие такую структуру молекулы диборана.)
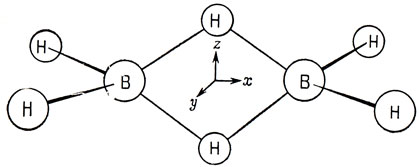
Рис. 14.1. Оси координат для молекулы В2Н6
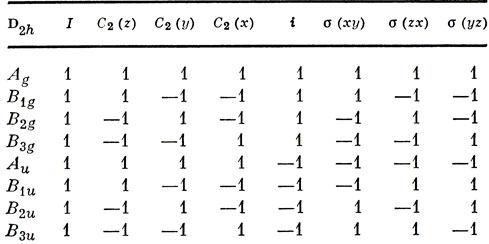
Таблица 14.1. Таблица характеров группы D2h
В расчете по методу МО берутся линейные комбинации шести водородных 1s-орбиталей и 2s- и 2р-орбиталей атомов бора. Расчет упрощается, если сначала построить групповые орбитали, которые преобразуются по НП группы симметрии. Затем нужно комбинировать лишь групповые орбитали, преобразующиеся по одному и тому же НП. Эквивалентная этой процедура, в которой легче просматривается связывание мостиковых атомов посредством МО, включает в себя, как первый шаг, гибридизацию АО бора. Остановимся на этом подробнее.
Угол между связями в концевых группах ВН2 близок к 120°, и можно предполагать, что эти связи возникают благодаря перекрыванию водородных 1s-орбиталей и sр2-гибридов атома бора. Если рассматриваемые гибриды действительно относятся к типу sp2, то остается
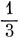
s- и
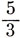
р-функции распределить между двумя другими гибридными орбиталями, направленными к мостиковым атомам водорода. Поскольку в каждой из этих двух орбиталей s- и p-характеры должны быть равны, волновые функции имеют вид
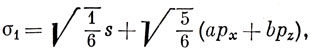
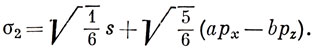
В силу симметрии рy-орбиталь не может вносить вклад в волновые функции. Коэффициенты а и b определяются из условий ортогональности
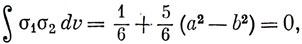
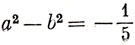
и нормировки
а2 + b2 = 1,
Отсюда следует, что
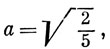
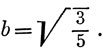
Орбиталь
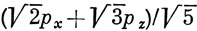
образует с осью х угол θ, тангенс которого равен
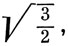
т. е. θ = 50°46'. Поэтому
гибриды σ1 и σ2 образуют между собой угол 101°32', что очень хорошо согласуется с величиной угла Н - В - Н, равной 96°36'.
Пусть орбитали, участвующие в образовании мостиковых связей, имеют вид, показанный на рис. 14.2 *). Пользуясь методом, изложенным в гл. 8, сначала построим из них групповые орбитали. Они приведены ниже.
*) (Напомним, что малыми буквами обозначаются орбитали, а большими - состояния всей молекулы (см. стр. 278-279).)
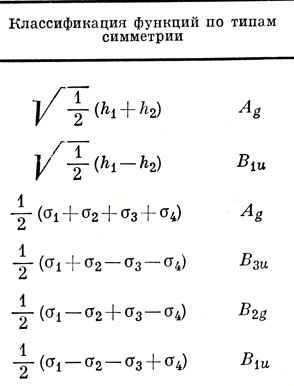
Две аg-орбитали дадут связывающую и разрыхляющую МО; то же самое получим и для b1u-орбиталей. Орбитали b3u и b2g - почти несвязывающие, хотя вследствие антисимметрии относительно отражения в плоскости yz они до некоторой степени разрыхляют связь В - В благодаря перекрыванию гибридных орбиталей σ1, σ4 и σ2, σ3. Если эти орбитали выразить снова через атомные, то оказывается, что b2g-орбиталь состоит целиком из атомных р-функций, а b3u - из гибридных sр2-функций. Поэтому двум несвязывающим орбиталям b3u соответствует более низкая энергия. Что касается связи Н - Н, то по отношению к ней орбиталь b1u - разрыхляющая, орбиталь ag - связывающая. Поэтому орбиталь ag характеризуется более низкой энергией. То же самое имеет место и для разрыхляющих орбиталей. Результаты приведены на рис. 14.3. В образовании мостиковых связей могут участвовать лишь четыре электрона; они занимают две связывающие МО аg и b1u. Эти орбитали имеют вид
ψ (ag) = c1 (h1 + h2) + с2 (σ1 + σ2 + σ3 + σ4),
ψ (b1u) = c3 (h1 - h2) + с4 (σ1 - σ2 - σ3 - σ4),
и показаны на рис. 14.4.
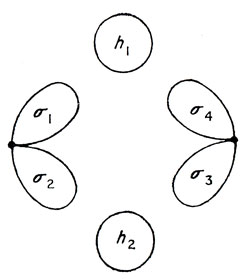
Рис. 14.2. Орбитали, образующие мостиковые связи в молекуле В2Н6
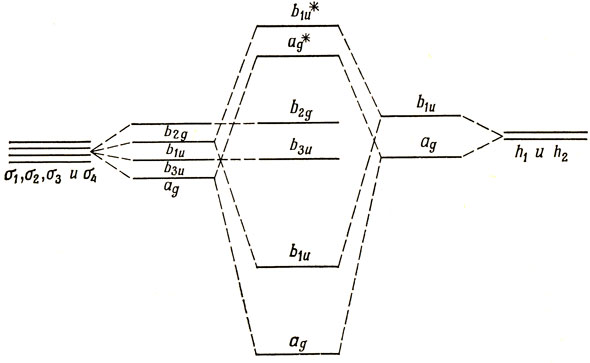
Рис. 14.3. Схема энергетических уровней МО, описывающих мостиковые связи в В2Н6
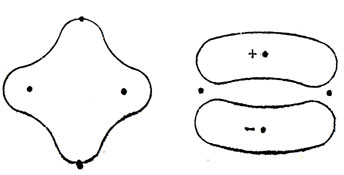
Рис. 14.4. Связывающие МО мостиковых связей в В2Н6
Эти орбитали преобразуются по соответствующим НП группы. Эквивалентные орбитали (стр. 255) можно получить, беря линейные комбинации функций ψ (ag) и ψ (b1u)- Эквивалентные орбитали локализованы на разных сторонах мостика и могут быть названы трехцентровыми связывающими орбиталями (рис. 14.5).

Рис. 14.5. Эквивалентные орбитали мостиковых связей в В2Н6
Молекулярные орбитали, полученные из трех перекрывающихся атомных или гибридных орбиталей, играют важную роль в химии соединений бора. Такой системе АО соответствует одна сильно связывающая, одна сильно разрыхляющая и одна приближенно несвязывающая МО. Таким образом, для образования трехцентровой связи необходимо лишь два электрона, и существование дополнительных электронов не увеличило бы прочность связи.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'