
14.2. Трехцентровые орбитали атомов бора
Мы уже познакомились с одним типом трехцентровых орбиталей, включающих два атома бора и один атом водорода. Существуют два других типа трехцентровых орбиталей, содержащие три атома бора и имеющие большое значение в химии бора. Одна из этих орбиталей является безузловой функцией, другая имеет узловую плоскость. Обе они возникают в том случае, когда атомы А и С имеют гибридные орбитали, ориентированные приблизительно на атом В, обладающий гибридной σ-орбиталью или р-орбиталью, как показано на рис. 14.6. Если атомы А и С эквивалентны, то в обоих случаях можно построить симметризованные комбинации
σ1 = σa + σc,
σ2 = σa - σc,
причем в силу симметрии σ1 может комбинировать с σb, но не с рb, а σ2 - с рb, но не с σb.
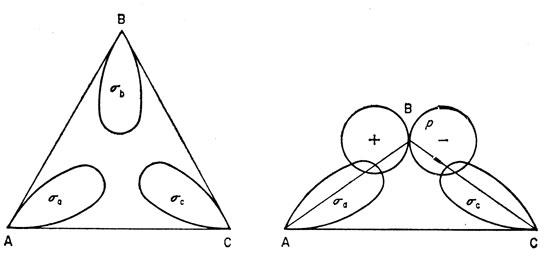
Рис. 14.6. Трехцентровые взаимодействия в соединениях бора
Случай а. Получаем МО
ψ3 = с3 (σa + σc) - с4 (σb),
ψ2 = σa - σc,
ψ1 = c1 (σa + σc) + c2 (σb),
где c1 ... с4 - положительные коэффициенты; ψ1 - связывающая орбиталь для связей А - С, А - В и В - С, так как она не имеет узлов; ψ2 - орбиталь, разрыхляющая связь А - С; ψ3 - орбиталь, разрыхляющая связи А - В и В - С и упрочняющая связь А - С. Очевидно, что к сильно связывающей орбитали можно отнести лишь ψ1. Если все три атома эквивалентны, ψ2 и ψ3 являются вырожденными и в одинаковой степени разрыхляющими.
Случай б. Получаем МО
ψ3 = c3 (σa - σc) - c4pb,
ψ2 = σa + bc,
ψ1 = c1 (σa - σc) + c2pb.
ψ1 разрыхляет связь А - С и упрочняет связи А - В и В - С; ψ2 упрочняет связь А - С; ψ3 разрыхляет связи А - В, В - С и А - С. В этом случае, однако, перекрывание орбиталей σа и σс мало, так что наиболее существенным является характер орбиталей по отношению к связям А - В и В - С. Как и в случае а, имеется одна сильно связывающая орбиталь ψ1. На рис. 14.7 показаны две трехцентровые связывающие орбитали для случаев а и б. Удобно изобразить эти два случая следующими схемами:
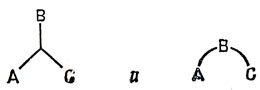

Рис. 14.7. Трехцентровые связывающие орбитали в соединениях бора
Теперь кратко рассмотрим связь в молекуле пентаборана В5Н11, структура которой показана на рис. 14.8. Четыре атома бора расположены в одной плоскости, причем два из них связаны с двумя концевыми атомами водорода каждый и два - с одним. Атом бора, находящийся в вершине, связан с двумя концевыми атомами водорода (для одного из атомов водорода можно до некоторой степени считать, что связь расположена в основной плоскости). В этой молекуле на первый взгляд должно быть восемнадцать двух электронных связей, однако имеется лишь двадцать шесть валентных электронов.
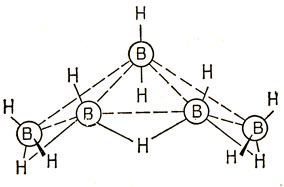
Рис. 14.8. Структура В5Н11
Выбор в качестве примера именно этого бороводорода обусловлен тем, что связи в нем можно описывать с помощью любой из трехцентровых орбиталей, изображенных на рис. 14.7, в зависимости от типа гибридизации, используемой для описания атома бора, расположенного в вершине. Угол Н - В - Н при этом атоме равен 116°, с точностью ±9°, и это совместимо с sp2- или sp3-гибридизацией.
На рис. 14.9 представлена молекула В5Н11 (вид сверху) для двух типов трехцентровых орбиталей.
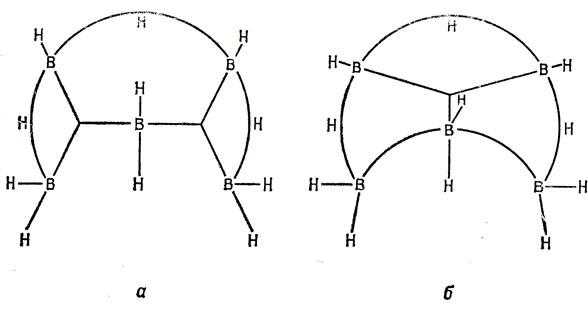
Рис. 14.9. Схемы связей в В5Н11. а - в предположении sр3-гибридизации находящегося в вершине атома бора; б - в предположении sр2-гибридизации находящегося в вершине атома бора
Для обоих случаев имеется тринадцать связывающих МО (восемь для концевых связей В - Н, три для мостиковых В - H - В и две для трехцентровых, включающих атомы бора). Эти орбитали заполнены двадцатью шестью валентными электронами. В настоящее время не существует данных для того, чтобы сказать, какая из этих двух схем связей в молекуле является лучшей.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'