
Глава 15. π-Электронное приближение в теории органических молекул
15.1. Введение
Химики-органики подразделяют углеводороды на три класса: насыщенные, ненасыщенные и ароматические. Насыщенные углеводороды - относительно инертные соединения, между тем как ненасыщенные и ароматические углеводороды участвуют в довольно большом количестве разнообразных химических реакций. Именно наличием π-электронов в молекулах двух последних классов объясняется их высокая реакционная способность.
В гл. 10 МО в двухатомных молекулах были охарактеризованы значением проекции момента импульса на ось молекулы: σ-орбитали, если эта проекция равна 0, и π-орбитали, когда она равна единице. Эти же обозначения применяют и для многоатомных молекул, однако они характеризуют в таком случае не значение проекции орбитального момента, а пространственные свойства орбитали. π-Орбиталь имеет узловую плоскость, проходящую через линию связи, а σ-орбиталь не обладает узловой плоскостью. Поэтому π-орбиталь молекулы этилена, например, похожа на π-орбиталь кислорода, представленную в действительной форме. Можно считать, что в насыщенных углеводородах электроны находятся только на σ-орбиталях, а в ненасыщенных и ароматических (например, этилен и бензол) - как на σ-, так и на π-орбиталях. Бензол и этилен представляют собой плоские молекулы; их σ-орбитали симметричны, а π-орбитали - антисимметричны по отношению к отражению в плоскости молекулы (см. рис. 5.15, 5.16).
В методе ВС невозможно описать π-связи в ароматических молекулах с помощью одной валентной схемы. Например, бензол изображается комбинацией структур Кекуле
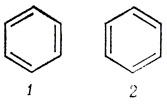
с некоторой малой примесью соответствующих более высокой энергии структур Дьюара *):
*) (Необходимо подчеркнуть, что эти структуры (соответствующие некоторым схемам спаривания электронов в методе ВС) построены на основе плоского остова из атомов углерода, имеющего вид правильного шестиугольника. Дело в том, что синтезированы неплоские молекулы бицикло [2.2.0] гексадиена, названные "бензолом Дьюара". Не следует смешивать их с обсуждаемыми здесь плоскими структурами Дьюара.)
Эти пять структур описывают всевозможные независимые схемы полного спаривания электронов в бензоле (стр. 268). Волновая функция для бензола может быть записана в виде
Ψ = с1Ψ1 + с2Ψ2 + с3Ψ3 + с4Ψ4 + с5Ψ5.
Коэффициенты с1 и с2 равны между собой так же, как и коэффициенты с3, с4 и с5.
Если бы только одна из структур Кекуле представляла основное состояние молекулы бензола, то энергия π-связей была бы равна утроенной энергии π-связи в молекуле этилена. Однако волновая функция, в которой учтены все пять структур, позволяет получить более низкое значение энергии, и разность этих энергий называют "энергией резонанса". В случае бензола две структуры Кекуле дают около 80% от всей энергии резонанса, получаемой при учете пяти структур. В более точных расчетах следует рассматривать также ионные структуры типа 6 и 7, хотя вклад, вносимый ими в энергию основного состояния, чрезвычайно мал.
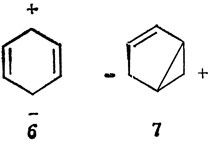
Для больших ароматических молекул число возможных ионных структур значительно возрастает, и хотя доля каждой из них в отдельности мала, полный вклад всех ионных структур в основное состояние становится заметным.
Для молекулы антрацена можно нарисовать четыре структуры Кекуле:
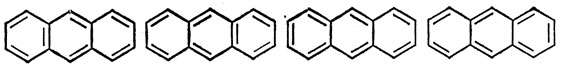
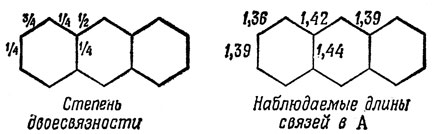
Хотя они не эквивалентны друг другу, им соответствует одинаковая энергия в приближении полного спаривания (12.31). Отсюда следует, что волновая функция основного состояния отвечает смеси всех четырех структур с одинаковым весом (в пренебрежении структурами, соответствующими более высоким значениям энергии). Производя усреднение по четырем структурам Кекуле для антрацена, определим дробную степень двоесвязности. Заметная степень двоесвязности 1-2-связи находится в согласии с химическими данными и с наблюдаемыми длинами связей (1,34 А в этилене, 1,40 А в бензоле и 1,54 А в этане).
Для больших молекул расчеты по методу ВС становятся чрезвычайно громоздкими, потому что приходится учитывать много структур (см. разд. 12.5). По этой причине в настоящее время большинство исследователей применяют для таких молекул метод МО.
Метод МО особенно пригоден в применении к молекулам ряда сопряженных олефинов и ароматических соединений, так как построение делокализованных орбиталей является основной чертой метода. Каждый атом углерода сопряженной системы в молекулах такого типа имеет один π-электрон на 2p-АО φν. МО в приближении ЛКАО [см. выражение (10.27)] имеют вид
ψ = ∑ν cν φν. (15.1)
Коэффициенты cν и орбитальные энергии находят, решая систему уравнений (10.30):
∑ν cν (Hμν - ESμν) = 0. (15.2)
Смысл одноэлектронного гамильтониана, входящего в эти уравнения, уже обсуждался раньше (разд. 10.7 и 12.4), и этот вопрос вновь будет рассмотрен в разд. 15.8.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'