
Глава 18. Слабая химическая связь
18.1. Силы Ван-дер-Ваальса
В этой книге рассматривалась главным образом теория ковалентной связи, энергия которой обусловлена делокализацией электронов. Существуют и такие силы взаимодействия между атомами (или молекулами), которые не связаны с делокализацией электронов; ионная связь, о которой уже говорилось раньше, является примером таких сил. Другой пример представляют слабые силы, ответственные за объединение неполярных молекул в жидкости и твердые тела. Эти силы обусловлены взаимодействиями нескольких типов; их объединяют под общим названием сил Ван-дер-Ваальса.
Мы не будем подробно обсуждать природу этих сил, так как эти вопросы лишь соприкасаются с теорией валентности и требуют детального рассмотрения поляризации молекул внешним электрическим полем. Ограничимся лишь кратким изложением классического объяснения сил Ван-дер-Ваальса.
Если молекула обладает зарядом или постоянным дипольным моментом, то она вызывает смещение заряда в соседней молекуле, и в результате возникает притяжение между постоянным и наведенным моментами. Энергию такого взаимодействия называют индукционной энергией.
Заряженная молекула индуцирует в соседней молекуле дипольным момент, пропорциональный 1/R2, где R - расстояние между молекулами. Энергия притяжения между зарядом и диполем изменяется как 1/R2, так что энергия взаимодействия заряд - индуцированный диполь (индукционная энергия) пропорциональна 1/R4. Дипольная молекула индуцирует в соседней молекуле дипольный момент, пропорциональный 1/R3, и потому энергия взаимодействия диполь - индуцированный диполь изменяется как 1/R6.
Если в нейтральной молекуле электронный заряд распределен сферически симметрично, то она не обладает постоянным дипольным моментом и, следовательно, индукционный вклад в вандерваальсовы силы равен нулю. В действительности это условие выполнено лишь для нейтральных атомов, но оно реализуется довольно хорошо и для молекул типа метана *). При классическом рассмотрении все же следует ожидать, что молекула (или атом) может иметь отличный от нуля мгновенный дипольный момент, среднее по времени от которого равно нулю. Этот мгновенный диполь индуцирует в соседней молекуле момент (пропорциональный 1/R3, а энергия взаимодействия мгновенного и индуцированного диполей пропорциональна 1/R6. Эту энергию называют дисперсионной, или лондоновской, энергией.
*) (Сферическое распределение заряда не является необходимым условием отсутствия дипольного момента. Достаточно сослаться, например, на гомоядерные двухатомные молекулы. - Прим. ред.)
Как индукционные, так и дисперсионные силы зависят от поляризуемости молекулы, которая определяется дипольным моментом, индуцированным однородным электрическим полем единичной напряженности μ = αε (в общем случае α - симметричный тензор второго ранга, имеющий шесть независимых компонент, например μx = αхх εх + αху εу + αxz εz). Индукционная энергия пропорциональна поляризуемости поляризованной молекулы, а дисперсионная энергия - произведению поляризуемостей двух взаимодействующих молекул. Дисперсионная энергия обычно больше индукционной, за исключением, быть может, случая, когда одна из молекул обладает постоянным зарядом.
Приближенное выражение для дисперсионной энергии взаимодействия между двумя молекулами А и В было получено Лондоном в виде
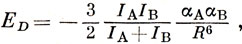
где I - потенциал ионизации; α - средняя поляризуемость 1/3 (ахх + ауу + azz). Например, энергия, притяжения двух молекул метана на расстоянии 3,8 А (среднее расстояние между молекулами в жидкости) составляет около 0,02 эв (0,5 ккал/моль).
Дисперсионные и индукционные силы возникают не только при взаимодействии различных молекул, но также и при взаимодействии между различными атомами или группами атомов в молекуле. Например, дисперсионным взаимодействием несвязанных групп С - Н объясняют различия в теплотах образования изомеров парафиновых углеводородов [67].
Одни лишь дисперсионные силы, вероятно, никогда не могут привести к возникновению комплекса из двух различных молекул. Поскольку произведение поляризуемостей двух разных молекул ссАав всегда меньше величины 1/2 (αA2 + αB2), можно ожидать, что два димера А2 и В2 обладают большей дисперсионной энергией, чем две молекулы АВ. Однако, в действительности, комплексы, состоящие из различных молекул, встречаются гораздо чаще, чем димеры; обратимся теперь к рассмотрению сил, действующих в этих случаях.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'