
18.2. Донорно-акцепторные комплексы
Молекулярным комплексом называют группу из двух или большего числа молекул, связанных между собой. Типичные примеры таких комплексов: BF3 ← NH3 и хинон - гидрохинон (хингидрон). Оба эти комплекса можно приготовить в виде кристаллов с точно определенной стехиометрией 1:1. Известно также много примеров, когда объединение двух молекул в комплекс происходит в растворе (получить такие соединения в виде кристаллов не удается). Одним из примеров такого рода является комплекс иод-бензол.
Все эти комплексы имеют общую особенность: одна из молекул является донором электронов, а другая - акцептором:
Донором электронов является молекула, облагающая слабо связанными электронами (например, неподеленная пара в NH3) и соответственно малым потенциалом ионизации. Благодаря этому свойству молекула может быть восстановителем или льюисовским основанием. Акцептор, с другой стороны, имеет вакантную орбиталь с низкой энергией (например, вакантная 2р-орбиталь в BF3). Акцепторы обладают большим сродством к электрону и могут быть окислителями или льюисовскими кислотами. Однако на самом деле способность к захвату или отдаче электронов (акцепторное и донорное свойства) следует всегда рассматривать по отношению к партнеру в комплексе. Так, фенильная группа захватывает электроны заместителя в молекуле анилина, но отдает их заместителю в нитробензоле; точно так же бензол ведет себя как донор по отношению к молекуле иода, но как акцептор по отношению к молекуле или атому с более сильными донорными свойствами (например, щелочному металлу).
Во многих случаях донорно-акцепторный комплекс сильно окрашен. Например, гидрохинон бесцветен, а хинон желтого цвета: кристаллы же хингидрона имеют характерный зеленый цвет с металлическим отливом. Аналогично растворы бензол - иод обнаруживают в ультрафиолетовой области полосу поглощения около 3000 А, которая отсутствует в спектрах иода и бензола в отдельности.
Первое удовлетворительное квантовомеханическое рассмотрение таких молекулярных комплексов было проведено Малликеном. Он показал, что как стабильность комплексов, так и их характерные электронные спектры поглощения связаны с донорно-акцепторными свойствами.
Пусть Ψ(D) и Ψ(А) - соответственно волновые функции донора и акцептора в отдельности. Волновую функцию системы из невзаимодействующих донора и акцептора можно записать в виде
Ψ∞ (D, A) = Ψ(D) Ψ(A). (18.2)
Подобно этому, если имеются ионы D+ и А-, разведенные на большое расстояние, волновой функцией такой системы является
Ψ∞ (D+, A-) = Ψ(D+) Ψ(A-). (18.3)
Когда две молекулы сближаются и их электронные облака перекрываются, то обе волновые функции следует исправить таким образом, чтобы учесть возможность обмена электронов в соответствии с принципом антисимметрии. Формально это можно сделать, если ввести оператор антисимметризации, который преобразует простое произведение в антисимметризованную сумму произведений *).
Ψ (D, A) = A Ψ (D) Ψ (A);
Ψ (D+, A-) = A Ψ (D+) Ψ (A-). (18.4)
*) (А φа (1) φb (2) = √1/2 {φа (1) φb (2) - φа (2) φb (1)} - простейший пример антисимметризации. Однако D и А могут не описываться волновыми функциями, состоящими из одного произведения спин-орбиталей, и антисимметризатор A не обязательно преобразует исходную функцию в слэтеровский определитель.)
Запишем полную волновую функцию молекулярного комплекса в виде линейной комбинации этих двух функций
Ψ = aΨ (D, А) + bΨ (D+, A-) (18.5)
и определим коэффициенты этой комбинации, решая соответствующие уравнения. При этом получим два решения. Соответствующие волновые функции можно представить в виде
Ψ1 = a1 Ψ (D, A) + b1 Ψ (D+, A-),
Ψ0 = a0 Ψ (D, A) + b0 Ψ (D+, A-). (18.6)
Энергия, соответствующая функции Ψ0, ниже энергий, отвечающих функциям Ψ (D, А) и Ψ (D+, - А-) в отдельности, и потому возможное объяснение стабильности комплекса следует искать именно во взаимодействии этих состояний. Электронный переход Ψ0 → Ψ1, которому нет аналога ни у донора, ни у акцептора, можно связать с полосами поглощения, характерными для комплекса.
Рассмотрим сначала слабые комплексы, которые обычно образуются органическими молекулами. В этом случае состоянию Ψ (D, А), которое Малликен называет несвязывающим, соответствует значительно более низкая энергия, чем ионному (с переносом заряда) состоянию Ψ (D+, - А-). Кроме того, матричный элемент гамильтониана, вычисленный с функциями Ψ (D, А) и Ψ (D+, - А-), обычно мал. Поэтому волновую функцию основного состояния можно записать в виде
Ψ0 = Ψ (D, A) + b0 Ψ (D+, A-), (18.7)
где b0 << 1, а волновую функцию возбужденного состояния в виде
Ψ1 = Ψ (D+, A-) + a1 (D, A), (18.8)
где а1 << 1. Поэтому электронный переход Ψ0 → Ψ1 сопровождается переносом почти целого заряда электрона от донора к акцептору, а полосу поглощения, связанную с таким переходом, называют полосой, обусловленной переносом заряда.
Наиболее сильным аргументом в пользу такой интерпретации полосы поглощения является частота перехода. Если взаимодействие между двумя компонентами волновой функции мало, то энергия перехода Ψ0 → Ψ1 почти совпадает с энергией перехода
Ψ (D, A) → Ψ (D+, A-),
т. е. приближенно равна [см. выражение (11.34)]
E (D+, A-) - E (D, A) = I (D) - A (A) + Q. (18.9)
Для ряда комплексов с одним и тем же акцептором, но различными донорами, соотношение
hν = I - K, (18.10)
где К - постоянная, выполняется удивительно хорошо, как видно из рис. 18.1. Это означает, что, хотя кулоновская энергия Q взаимодействия двух ионов довольно велика, она не сильно зависит от природы донора.
![Рис. 18.1. Корреляция между энергией в максимуме полосы, обусловленной переносом заряда, и потенциалом ионизации донора для комплексов иода с органическими донорами [6]](pic/000833.jpg)
Рис. 18.1. Корреляция между энергией в максимуме полосы, обусловленной переносом заряда, и потенциалом ионизации донора для комплексов иода с органическими донорами [6]
Взаимодействие между несвязывающим и возникшим в результате переноса заряда состояниями зависит от перекрывания теряющей электрон орбитали донора D (донорной орбитали) с орбиталью акцептора А (акцепторной орбиталью), которая захватывает электрон. Это легко видеть в простейшем случае одноэлектронной системы:
Ψ (D, A) = ψd, Ψ (D+, А-) = ψа, (18.11)
где ψd - донорная орбиталь D; ψa - акцепторная орбиталь А. Тогда
∫ Ψ (D, А) H (D+, A-) dτ = ∫ ψd H ψa dυ, (18.12)
и этот интеграл обращается в нуль, когда орбитали ψd и ψа не перекрываются: если в любой точке некоторой области или ψd или ψa равны нулю, то вклад в интеграл по этой области пространства равен нулю. В общем случае интеграл взаимодействия приблизительно пропорционален интегралу перекрывания Sda, a энергия стабилизации пропорциональна Sdа2 (второй порядок взаимодействия) [см. выражение (17.7)].
В типичных органических комплексах, подобных хингидрону, донорные и акцепторные орбитали представляют собой делокализованные молекулярные π-МО и область перекрывания этих двух орбиталей делокализована, как это показано на рис. 18.2. Если говорят о химической связи между двумя компонентами молекулярного комплекса, нужно помнить, что эта связь - делокализованная, и ее невозможно изобразить, рисуя линию, соединяющую два атома. Энергия связи комплексов типа хингидрона обычно лежит в интервале 0,1-0,5 эв (2-10 ккал/моль). Это немного больше, чем энергии, которые соответствуют лондоновским дисперсионным силам взаимодействия, и потому, хотя получены убедительные доказательства, позволяющие объяснять образование комплексов в таких случаях переносом заряда, довольно большая часть энергии связи происходит, вероятно, от дисперсионных сил.
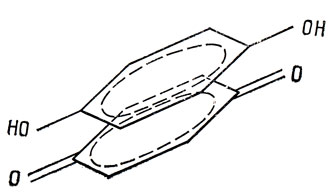
Рис. 18.2. Структура хингидрона
К совершенно другому случаю относятся комплексы типа BF3 ← NH3. Расчет показывает, что в этих комплексах состоянию Ψ (D+, А-) соответствует приблизительно та же энергия, что и состоянию Ψ (D, А), и одно лишь это говорит в пользу большой энергии связи. Но, что более важно, донорные и акцепторные орбитали теперь не являются делокализованными МО, а представляют собой сильно перекрывающиеся гибридные АО. Взаимодействие между несвязывающим и возникшим при переносе заряда состояниями дает для энергии связи комплекса BF3 ← NH3 величину около 2 эв, что много больше энергии связи для комплексов типа хингидрона. Эта большая стабилизация основного состояния должна сопровождаться большой дестабилизацией (повышением энергии) возбужденного состояния. В случае комплекса BF3 ← NH3 расстояние между уровнями энергии основного и возбужденного состояний слишком велико для того, чтобы полоса, соответствующая переходу с переносом заряда, наблюдалась в области более длинноволновой, чем 2300 А, где начинается собственное поглощение NH3.
Теория переноса заряда в молекулярных комплексах, рассмотренная здесь, очень похожа на метод ВС в применении к двухатомным молекулам. Это становится совершенно очевидным, если в качестве D и А взять атомы, а не молекулы. Как уже говорилось, простейшая волновая функция, построенная по методу ВС, лучше, чем простейшая функция метода МО, если атомы слабо связаны друг с другом, так как в предельном переходе МО приводит к неверному описанию продуктов диссоциации. Поэтому теория переноса заряда в слабых молекулярных комплексах дает лучшее описание, чем трактовка по методу МО, в которой электроны размещают на орбиталях, делокализованных в области донора и акцептора. С другой стороны, для комплексов с сильной связью, где основное состояние может быть представлено почти равной смесью функций Ψ (D, А) и Ψ (D+, А-), столь же хорошо и, возможно, даже лучше использовать делокализованные МО. В методе МО нет различия между связью В - N в BF3 ← NH3 и связью Li - Н: обе двухэлектронные связи имеют в большой степени ионный характер.
Термин "перенос заряда", используемый при описании связи в молекулярном комплексе, понимается в том же смысле, как и термины "структура" и "резонанс". Эти понятия связаны с частной квантовомеханической моделью, а не с физически наблюдаемыми величинами. С другой стороны, когда термин "перенос заряда" используется в описании электронной полосы поглощения, то имеется в виду, что при возбуждении комплекса значительная часть электронного заряда передается от донора к акцептору, и с этой точки зрения перенос заряда означает не просто условное понятие, а нечто значительно более реальное.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'