
18.3. Водородная связь
Во многих случаях, когда существует необычно сильная связь между молекулами или между разными группами в одной и той же молекуле, эксперимент показывает, что в связи участвует атом водорода. Речь идет о так называемой водородной связи. Основанием для этого служат четыре источника данных:
1. Физические свойства, такие, как диэлектрическая проницаемость и точка кипения (например, вода, молекулы которой образуют водородные связи, имеет более высокую точку кипения и большее значение диэлектрической проницаемости, чем метан, молекулы которого не образуют водородных связей).
2. При изучении инфракрасных спектров и спектров комбинационного рассеяния А - Н-валентных колебаний обнаружены изменения в положении, интенсивности и форме спектральных полос.
3. Из наблюдений ядерного магнитного резонанса найдено, что химические сдвиги некоторых протонов очень чувствительны к природе растворителя.
4. Расположение атомов водорода в кристаллах (определяемое либо непосредственно методом дифракции рентгеновских лучей или нейтронов, либо косвенно - по уширению линий ядерного магнитного резонанса) показывает в некоторых случаях, что отдельный атом связан с двумя соседями.
Вот типичные примеры:
A. В кристаллах KHF2 анион (F - Н - F)- представляет линейную группу, и атом водорода расположен посередине между атомами фтора.
B. Кристаллы щавелевой кислоты имеют одну кристаллическую модификацию со следующим расположением атомов:
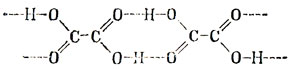
Расстояние О - О необычно мало (2,5 А), а водородный атом не находится посередине между атомами кислорода.
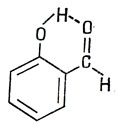
С. В салициловом альдегиде имеется внутренняя водородная связь, в которой атом водорода, принадлежащий группе фенола, слабо связан с кислородом альдегида, как это показано на следующей структурной схеме:
Теоретическая химия может помочь выяснению природы водородной связи в двух направлениях. Во-первых, анализ колебательных свойств связи дает сведения о форме поверхности потенциальной энергии, а во-вторых, теория валентности может объяснить происхождение этой поверхности. Здесь мы ограничимся лишь вторым направлением - укажем на различные возможные формы кривых потенциальной энергии (см. рис. 18.3): а - симметричная кривая с одним минимумом (пример А); б - симметричная кривая с двумя минимумами (пример В); в - асимметричная кривая с двумя минимумами (вероятно, редко встречающаяся); г - асимметричная кривая с одним минимумом (пример С).
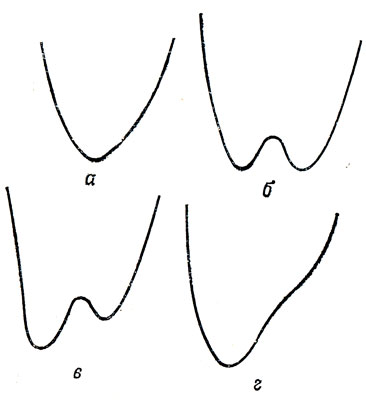
Рис. 18.3. Кривые потенциальной энергии для водородных связей
Относительно природы водородной связи высказывалось много соображений; опубликовано также несколько расчетов по методу ВС, но все это позволяет нарисовать лишь некоторую качественную картину.
В образовании водородной связи участвуют только полярные связи, например О - H, N - H, F - H, S - Н. Во всех случаях водород образует положительный конец диполя. Связи С - Н обычно не входят в водородные связи, за исключением, возможно, молекул типа СНСl3, где полярность связи С - Н увеличена за счет притяжения электронов атомами хлора. Отсюда можно заключить, что энергия водородной связи имеет главным образом электростатическое происхождение и основанные на этом заключении расчеты дают для нее величину 0,2-0,5 эв, что по порядку величины действительно соответствует энергии водородных связей.
Рассмотрим энергию связи типа О - Н ... О (пример В). Когда атомы кислорода расположены далеко один от другого, мы имеем обычную двухэлектронную связь О - Н, а второй атом кислорода содержит неподеленную пару электронов, направленную к атому водорода:
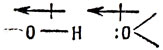
Дипольный момент связи О - Н и атомный дипольный момент неподеленной пары, очевидно, ориентируются таким образом, что между двумя группами возникает электростатическое притяжение. Однако существует много систем, в которых электростатическое притяжение не приводит к образованию связи (например, два атома гелия). Причиной этого является то, что при взаимодействии заполненных электронных оболочек обменная энергия имеет отталкивательный характер и превышает энергию электростатического взаимодействия. Таким образом, наилучшее объяснение, которое можно предложить для образования слабых водородных связей - малость обменной энергии. Энергия мала прежде всего потому, что атом водорода есть единственный из атомов, не имеющий электронов внутренних оболочек и, во-вторых, потому, что в полярных связях типа ОН электронная плотность около протона мала. Именно отсутствие сильного обменного отталкивания позволяет двум атомам приблизиться с разных сторон к одному протону, что приводит к большой энергии электростатического притяжения.
Хотя не было получено действительно убедительного расчета слабых водородных связей, все же, по-видимому, структуры с "длинными связями" (состояния с переносом заряда), такие, как О-Н - О+/\, вносят незначительный вклад в полную энергию связи [82]. Они могут, однако, оказывать существенное влияние на форму поверхности потенциальной энергии и вызывать изменения длины связи ОН и силовой постоянной, которые происходят при образовании водородной связи.
Для сильных симметричных водородных связей (пример А) наблюдается совершенно иная картина. Их, вероятно, лучше всего интерпретировать сначала, как систему делокализованных электронов. Например, анион (FHF)-, видимо, будет представлять задачу такого же типа, как мостиковая связь В - Н - В в диборане. По-видимому, не будет больших разногласий в оценке вклада электростатических сил в наблюдаемую энергию связи системы HF и F-, которая составляет приблизительно 50 ккал/моль [83]. Расстояние между атомами фтора равно только 2,26 А, что много меньше удвоенного радиуса иона F-, и потому модель, согласно которой протон удерживает два иона F- вместе, представляется не очень убедительной. С точки зрения метода МО анион (FHF)-, в некотором смысле аналогичен молекуле F2: все МО, которые можно построить из АО, заполнены, за исключением наиболее разрыхляющей.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'