
18.4. Сандвичеобразные соединения
(Мы, конечно, не утверждаем, что все сандвичеобразные соединения обладают слабыми химическими связями, однако считаем, что удобнее всего обсуждать структуру таких соединений именно в этом месте книги.)
В настоящее время известно много так называемых сандвичеобразных молекул, в которых атом переходного металла связан симметрично с двумя ненасыщенными углеводородами. На рис. 18.4 показана структура молекулы ферроцена, или дициклопентадиенила железа, которая, по-видимому, является наиболее известным примером молекул такого типа. Было найдено, что к атому металла может присоединиться один такой углеводород, если только присутствуют также другие лиганды, такие, как окись углерода или трифенилфосфин. По-видимому, есть большое сходство между связывающими свойствами циклопентадиенила, с одной стороны, и окиси углерода или трифенилфосфина, с другой.
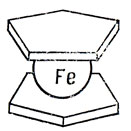
Рис. 18.4. Сандвичеобразная структура ферроцена
Считают, что окись углерода связана с атомом переходного металла посредством как σ-, так и π-связей. Для σ-связи характерно частичное оттягивание электронов на атом металла. В случае же π-связи наблюдается частичный переход электронов металла на низшую вакантную орбиталь лиганда. Система остается повсюду приблизительно нейтральной. Предполагают также, что σ- и π-связи усиливают друг друга (это часто называют синэргическим процессом): отдача σ-электронов окисью углерода делает лиганд более сильным акцептором π-электронов и наоборот. Эта идея была распространена на углеводородные лиганды Дьюаром [20] (комплекс серебро - этилен) и Чаттом и Дункансоном [8] (комплекс платина - этилен). Они предположили, что занятые связывающие π-орбитали этилена ведут себя как доноры электронов, а вакантные разрыхляющие π-орбитали - как акцепторы (рис. 18.5). Такое описание теперь общепринято и распространено на многие другие углеводородные лиганды. Однако оно не может объяснить, почему стабильность комплекса сильно зависит от природы олефина. Очевидно, следует учитывать нечто большее, чем просто наличие донорных и акцепторных орбиталей.
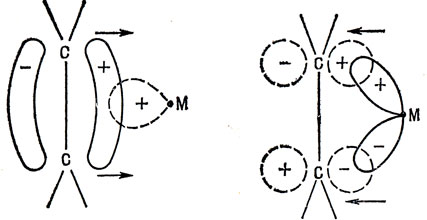
Рис. 18.5. σ- и π-Связывание в комплексах металл - олефин
Молекула ферроцена обладает симметрией D5d, и первым шагом при обсуждении связи в этой молекуле должна быть классификация взаимодействующих орбиталей по НП группы симметрии. Мы будем рассматривать только π-орбитали циклопентадиеновых колец, так как им соответствует наиболее высокая энергия, а также наиболее сильное перекрывание с d-орбиталями металла. МО С5Н5 преобразуются по НП A1, E1 и Е2 группы симметрии циклопентадиенила D5h, и два набора МО обладают симметрией A1g + А2u + E1g + E1u + E2g + Е2u группы симметрии ферроцена D5d. АО центрального атома характеризуются следующими свойствами симметрии:
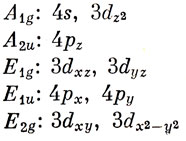
Рассматривая перекрывание орбиталей лигандов и металла, обладающих одинаковыми свойствами симметрии, получаем диаграмму энергетических уровней МО, показанную на рис. 18.6.
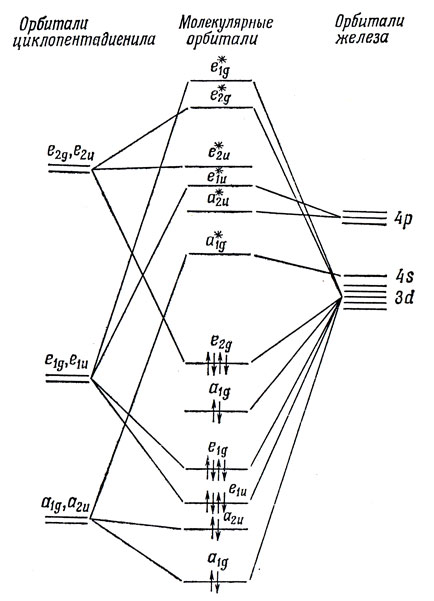
Рис. 18.6. Схема энергетических уровней МО молекулы ферроцена
Восемнадцать валентных электронов располагаются на этих МО так, что все орбитали, вплоть до e2g, заполнены. Добавление следующих электронов, как и в аналогичных соединениях кобальта и никеля, приводит к парамагнетизму. Однако магнитные моменты согласуются только с числом неедаренных электронов на вырожденных орбиталях (вероятно, е2u*), и потому порядок расположения разрыхляющих орбиталей оказывается зависящим от металла.
Для молекулы ферроцена были выполнены полуэмпирические расчеты по методу МО с самосогласованием. Но, к сожалению, полученные характеристики связи существенно зависят от выбора орбиталей атома железа. При использовании слэтеровских орбиталей эффективный заряд на атоме железа получается равным +0,68 [76]. Если же в расчете используются самосогласованные АО, то эта величина оказывается равной -0,69 [19]. Хотя знак заряда весьма сомнителен, все же ясно, что по величине заряд мал и соответствует переносу самое большее 2/3 заряда электрона между каждым кольцом и атомом железа. Это подтверждает тот взгляд, что подход, предложенный Дьюаром, Чаттом и Дункансоном для этиленовых комплексов, более широко применим и что в молекуле ферроцена имеет место некоторая компенсация результирующих зарядов, вызванная встречными процессами делокализации систем металл - циклопентадиен и циклопентадиен - металл.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'