
Глава 17
17.1.
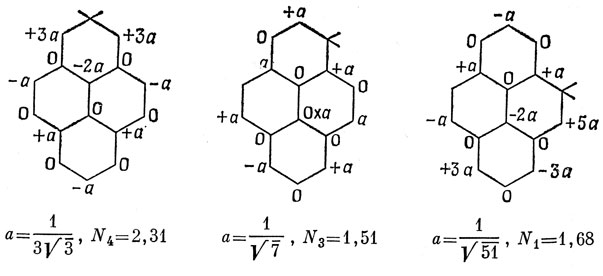
Чем меньше индекс Дьюара, тем меньше энергия локализации и легче атака. Таким образом, предсказываемые скорости атаки для пирена располагаются в следующем порядке:
3 > 1 >> 4.
17.2. Заменим отрицательно заряженный атом кислорода в нафтолятном анионе на метиленовую группу и, используя коэффициенты несвязывающих орбиталей, получим следующие заряды на атомах:
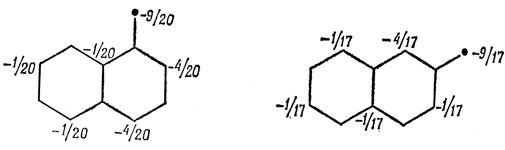
Таким образом, можно предсказать, что α-нафтол будет сочетаться с солями диазония с одинаковой легкостью в положениях 2 и 4, а β-нафтол - только в положении 1 (эти предсказания хорошо согласуются с экспериментом). Приближение изолированной молекулы дает в этом случае хорошие результаты, вероятно, потому, что нафтолятные анионы представляют собой заряженные системы, и поэтому π-электронные заряды на атомах углерода сильно различаются между собой.
17.3. Если имеются два основания B1 и В2 с константами K1 и К2 диссоциации сопряженных им кислот и нужно сравнить эти основания в данном растворителе при данной температуре, можно написать
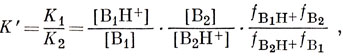
где f - коэффициент активности.
Можно, таким образом, связать константу равновесия К с изменением стандартной свободной энергии при переходе протона от B1 к В2:
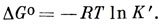
Гамметт показал, что с достаточно хорошей степенью приближения отношения коэффициентов активности для двух сходных оснований в одной и той же среде равны, т. е.
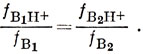
Делая такое допущение, можно приравнять ΔG° изменению потенциальной энергии при переходе протона от В1 к В2.
Предположим, что это изменение потенциальной энергии вызвано главным образом различием между π-электронными энергиями B1H+ и В2H+, т. е.
δ E2 - δ E1 ≈ ΔG° = - R T ln К' = 2,303 R T (pK1 - рK2).
Первый вопрос, который следует поставить, таков: какой из атомов азота в аминохинолине предпочтительнее будет атакован протоном? Если это относится к гетероатому азота, то в первом приближении будем считать, что для него изменяется лишь кулоновский интеграл α; если же это относится к экзоциклической группе NH2, то мы удаляем два электрона из π-электронной системы, поэтому протонирование атома азота в кольце приводит к меньшей потере π-электронной энергии, чем протонирование экзоциклического атома азота.
Как уже говорилось, если кулоновский интеграл μ-го атома изменяется на малую величину δαμ, то изменение π-электронной энергии равно
δ E = qμ δ αμ = l,2 β qμ.
В альтернантных углеводородах π-электронные заряды на всех атомах равны единице. Можно вычислить электронный заряд на углеродном атоме 1 в изомерных аминохинолинах, рассматривая аминогруппы, как группы CH2-, и помня, что можно очень просто вычислить коэффициенты в несвязывающей МО.
Значения с0 получаются из следующих диаграмм:
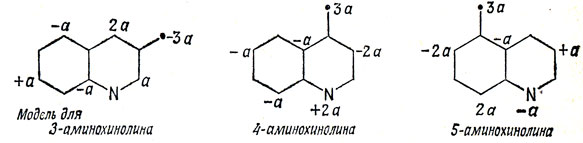
Таким образом, можно записать:
для 3-аминохинолина
δ E2 - δE1 = 0,
pK3-амино- ≈ pKхинолина,
для 4-аминохинолина (R = 1,98 ккал/град·моль):
δ E2 - δ E1 = - 1,2·20000· 4/20 = - 2,303·RT (рK - 5),
рK = 3,6 + 5 = 8,6,
для 5-аминохинолина:
δ Е2 - δ Е1 = - 1,2·20000·1/20 = - 2,303 · R T (рK - 5),
рK = 0,9 + 5 = 5,9.
Экспериментальные значения pK для 3-амино-, 4-амино- и 5-аминохинолинов равны 5; 9,2 и 5,5 соответственно.
17.4. В предыдущей задаче присоединение протона к хинолиновым основаниям не приводило к изменению общего числа π-электронов, и было вычислено изменение π-электронной энергии через изменение α. В приводимых ниже примерах при переходе от толуола к бензильному аниону или от циклопентадиена к циклопентадиенильному аниону наблюдается увеличение числа π-электронов. Предположим, что полная π-электронная энергия углеводорода АН равна 2nα + aβ, а аниона составляет (2n + 2) α + bβ (анион имеет на два π-электрона больше и еще один атом в сопряженной системе). Тогда можно выразить изменение π-электронной энергии Δε следующим образом:
Δε = (2n + 2) α + bβ - 2nα - аβ - Еσ = 2α + (b - а) β - Еσ,
где Eσ - энергия σ-связи С - Н, разрываемой в процессе ионизации, которую можно считать приблизительно одинаковой для различных σ-связей С - H. Если же рассматривать другой углеводород А'H, то различие в энергии депротонирования этих двух углеводородов дается выражением
Δε - Δε' = [(b - а) - (b' - а')] β.
Рассуждая так же, как и в предыдущей задаче, получим следующее выражение:
Δε - Δε' = ΔG° = 2,303 R T (рK' - рK).
Теперь задача сводится к вычислению а, b и а', b'. Для циклопентадиена это очень просто, так как в методе Хюккеля π-электронная энергия циклопентадиена такая же, как и у бутадиена (см. стр. 353), т. е. 4,48β. π-электронная энергия циклопентадиенильного аниона получается из выражения (15.24). На орбитали ψ1 находятся два электрона (E1 = α + 2,00β), а на двух вырожденных орбиталях ψ2 и ψ3 - четыре электрона (Е2 = Е3 = α + 0,62β). Таким образом,
b - а = 6,48 - 4,48 = 2,00.
π-Электронная энергия толуола в рассматриваемых приближениях такая же, как у бензола, и из выражения (15.24) следует, что ε = 6α + 8β. Не существует простого способа определения орбитальных энергий бензильного аниона. Можно слегка упростить расчет, используя симметрию. Бензил относится к группе симметрии С2, и можно, следовательно, нарисовать следующие диаграммы:
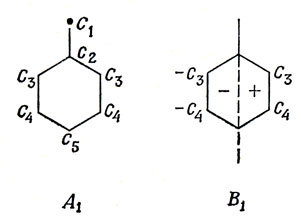
Записав, как обычно, вековые уравнения и решая их относительно х (представляют интерес только те значения х, которые отрицательны или равны нулю, так как рассматриваются только заполненные орбитали), получим следующие значения:
x = - 2,10; - 1,26; - 1,00; 0.
Поскольку бензил является нечетным альтернантным углеводородом, высшая заполненная орбиталь будет несвязывающей. Полная π-электронная энергия бензильного аниона равна 8α + 8,72β. Комбинируя эти результаты с полученными для бензола, имеем
b' - a' = 8,72 - 8,00 = 0,72.
Поэтому окончательное выражение запишется в виде
pК' - pK = 1,28·20000 / 2,303·1,987·298 ≈ 18,5.
Экспериментальное значение равно 21.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'