
§ 31. Производство азотной кислоты
Раньше, когда еще не существовало производства синтетического аммиака, азотную кислоту получали на заводах действием серной кислоты на чилийскую селитру. Кислота использовалась только для производства взрывчатых веществ, красителей и некоторых других химических продуктов. Сейчас же азотную кислоту получают из синтетического аммиака и перерабатывают главным образом в азотные удобрения.
Как из аммиака получить азотную кислоту?
Для этого необходимо провести последовательно несколько реакций, каждая из которых уже изучена вами:
4NH3 + 5O2 = 4NO + 6H2O + Q (1)
2NO + O2  2NO2 + Q (2)
2NO2 + Q (2)
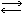 2NO2 + Q (2)
2NO2 + Q (2)3NO2 + H2O = 2HNO3 + NO + Q (3)
Получим азотную кислоту из аммиака в лабораторной установке (рис. 21). Аммиачновоздушную смесь будем получать, пропуская струю воздуха через аммиачную воду. В горизонтально расположенной стеклянной трубке поместим зерна катализатора - окисла металла. Чтобы реакция началась, необходимо подогреть катализатор. Затем нагревание прекращаем, так как требующаяся температура поддерживается за счет теплоты реакции.
Рис. 21. Лабораторная установка для окисления аммиака
Газовая смесь, выходящая из трубки, попадает в склянку, в которой окись азота окисляется кислородом, оставшимся в смеси. В двугорлой склянке двуокись азота реагирует с водой с образованием водного раствора азотной кислоты.
На заводских установках очищенный от нежелательных примесей воздух смешивают с чистым газообразным аммиаком. Так как окисление аммиака на катализаторе из платинородиевых сплавов протекает очень быстро, катализатор применяют в виде сеток, сплетенных из тонких нитей. Пакет из нескольких сеток помещают горизонтально в контактном аппарате (рис. 22). Применяют также катализаторы, состоящие только из одной платинородиевой сетки и окислов металлов (железа и других). Благодаря этому в несколько раз уменьшается количество драгоценных металлов, используемых в качестве катализатора в азотнокислых цехах.
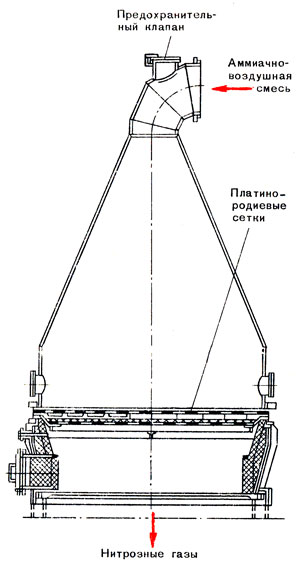
Рис. 22. Разрез контактного аппарата для окисления аммиака
При пуске аппарата катализатор подогревают. Через несколько минут устанавливается необходимая температура, которая затем поддерживается за счет теплоты реакции.
Из контактного аппарата так называемые нитрозные газы, содержащие около 11% окиси азота, выходят с очень высокой температурой - до 800°С. Между тем следующие реакции нужно, как мы знаем, проводить при обычной температуре. Следовательно, необходимо охладить газ, используя, разумеется, теплоту реакции для каких-либо полезных целей, проще всего для получения водяного пара. Поэтому нитрозный газ направляют в паровой котел-утилизатор.
Двуокись азота, образующуюся в результате окисления окиси азота, приводят в соприкосновение с водой. Образование азотной кислоты протекает в башнях с насадкой, с устройством которых вы познакомились, изучая производство серной кислоты. Только эти башни сооружают из листов хромоникелевой стали, стойкой к действию азотной кислоты и окислов азота.
Так как скорость окисления окиси азота в двуокись азота резко увеличивается с повышением давления, процесс проводят под повышенным давлением - до 10 ат. Объем аппаратов в таких установках значительно меньше, чем в ранее построенных установках, в которых процесс ведется под атмосферным давлением.
Вследствие обратимости реакции двуокиси азота с водой образуется разбавленная азотная кислота, содержащая только 50-60% HNО3. Она применяется для производства азотных удобрений.
Как получить концентрированную, например 98-процентную, кислоту, необходимую для производства красителей и других органических веществ?
Можно предложить сместить равновесие:
4NО2 + О2 + 2H2О 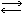 4HNО3 + Q
4HNО3 + Q
 4HNО3 + Q
4HNО3 + Qповысив давление. Действительно, на заводах получают концентрированную кислоту, проводя реакцию при давлении около 50 ат.
Ее получают и другим способом: к разбавленной азотной кислоте прибавляют концентрированную серную кислоту. При нагревании такой смеси испаряется только азотная кислота, а вода и, разумеется, серная кислота остаются жидкими.
До сих пор еще можно наблюдать на некоторых азотнокислотных установках, что из трубы в атмосферу выбрасывается окрашенный двуокисью азота газ - "лисий хвост". Чем это объясняется? Уловить полностью окислы азота очень трудно, так как скорость окисления окиси азота из-за низкой концентрации ее в уходящем газе очень мала.
Мы знаем, какой вред наносят окислы азота здоровью людей. Они губительно действуют и на растительность. Поэтому на современных установках уходящие газы подогревают, затем на катализаторе разлагают окислы азота и только после этого газы выпускают в атмосферу.
- Какие общие принципы химического производства используются при А получении азотной кислоты?
- В настоящее время проектируются агрегаты для получения азотной кислоты производительностью 1000 т кислоты в сутки, считая на 100-процентную. Сколько аммиака расходуется в таком агрегате в сутки, если выход окиси азота при контактном окислении аммиака равен 98%, а превращается в азотную кислоту 99% окиси азота? Сколько 55-процентной азотной кислоты получается "а таком агрегате в сутки? (Решите задачу, не составляя уравнений (реакций.)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'